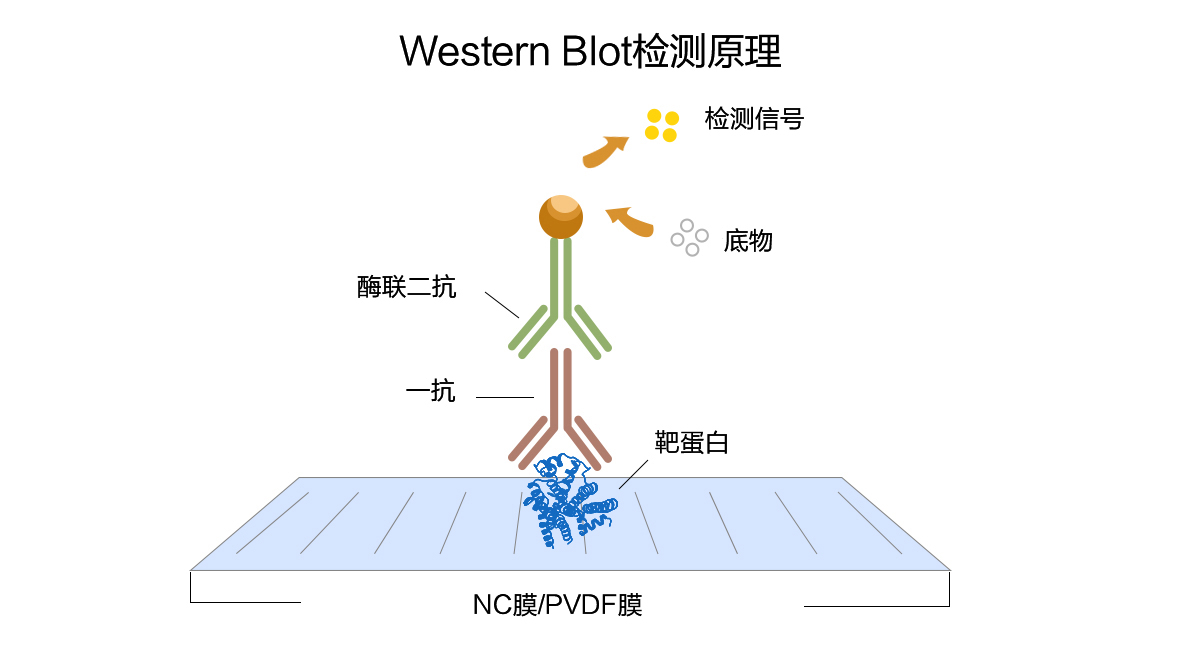
免疫印迹(Western blot)简介和原理
免疫印迹用于鉴定能够与特异性抗体相互作用的大分子抗原(一般为蛋白质)并测定抗原的大小。蛋白质首先通过SDS聚丙烯酰胺凝胶电泳分离,再通过电泳转移到固相支持物上,固相支持物包括硝酸纤维素膜,聚偏乙烯二氟(PVDF)膜和阳离子尼龙膜等。首先把膜上未反应的位点封闭起来以抑制抗体的非特异性吸附,这样固定的蛋白即可与特异性的多克隆或单克隆抗体相互作用。最后通过放射,生色或化学发光的方法进行定位。
实验常规试剂
1. 1.0 mol/L TrisHCl (pH6.8)
2. 1.5 mol/L TrisHCl(pH8.8)
3. 10% SDS
4. 10% 过硫酸胺(APS)
7. 还原型 5XSDS 上样缓冲液
8. 10X电泳液缓冲液
9. 10X转膜缓冲液
10. 1X转膜缓冲液
11. 10XTBS缓冲液
12. 1XTBST缓冲液
13. 封闭缓冲液: 1X TBST 含5% w/v 脱脂牛奶或者1X TBST 含2%-5%的牛血清白蛋白(BSA)。
14. 一抗/二抗稀释缓冲液: 常规稀释液使用的是含5% BSA 或5%脱脂牛奶的1X TBST,见一抗/二抗说明书;每种Elabscience®抗体都有固定的最佳稀释比例。
操作步骤
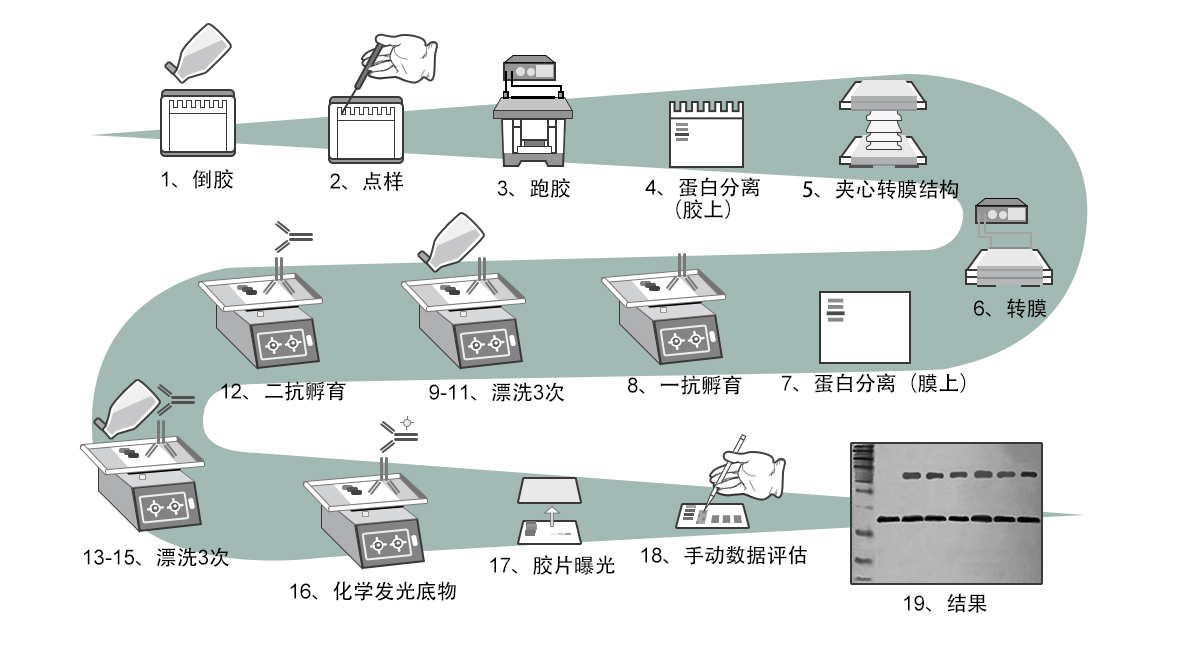
1. 根据待测蛋白分子量大小确定凝胶(分离胶)浓度制胶
2. 上样 使用适当的裂解液以及裂解方法裂解贴壁细胞、悬浮细胞或者组织样品。
3. 跑胶: 浓缩胶推荐用 80 伏电压,待样品进入分离胶后,可用 120-180 伏电压。
4. 跑胶完成以后,需先将胶上无样品的多余部分切除,滤纸和海绵需要预先润湿。
5. 分离的蛋白转移至膜载体上
选择合适的膜
转膜:以NC膜为例
提前十分钟到半小时用转膜 Buffer 润洗 NC 膜
按照以下的结构来安装转膜体系:负极-海绵-三层滤纸-胶-膜-三层滤纸-海绵-正极。
6. 转膜,一般为 2 小时。
7. 转完后将膜用1×丽春红染液染5 min(于脱色摇床上摇)。然后用水冲洗掉没染上的染液就可看到膜上的蛋白。 将膜晾干备用。
8. 抗原检测
免疫印迹膜上非特异性蛋白质结合位点的封闭:
a. 转好的膜先用 TBST 润洗两次,每次五分钟。低速水平摇床,常温。
b. 用 5%的脱脂牛奶(TBST 配制)常温封闭一至两小时。封闭过程应在常温下置于转速较低的水平摇床。
抗体与抗原特异性结合:一抗孵育
9-11.用 TBST 洗膜三次,每次十分钟。
12. 常温下用二抗孵育一到两个小时。
13-15. 用 TBST 洗膜三次,每次十分钟。
16. 准备 ECL 底物,对 8×5 cm 的膜,2毫升(1 毫升 A 加1 毫升 B)足够。将膜浸润底物中 1 分钟,然后取出,用滤纸吸掉膜上多余的底物。
17. 用 x-ray 底片曝光,根据信号的强弱适当调整曝光时间,一般为1 min或5 min,也可选择不同时间多次压片,以达最佳效果;曝光完成后,打开X-光片夹,取出X-光片,迅速浸入显影液中显影,待出现明显条带后,即刻终止显影。
Western blot常见问题分析指南
为什么电泳的条带很粗?
电泳中条带很粗是常见的事,主要是未浓缩好的原因。
处理办法:适当增加浓缩胶的长度;保证浓缩胶贮液的pH正确;适当降低电泳时的电压;
为什么电泳电压很高而电流却很低呢?
这种现象一般初学者易出现。比如电压50v以上,可电流却在5mA以下。主要是由于电泳槽没有正确装配,电流未形成通路。包括:a.内外槽装反;b.外槽液过少;c.电泳槽底部的绝缘体未去掉(比如倒胶用的橡胶皮)。
处理办法:电泳槽正确装配即可。