Western Blot虽是实验室最常用的蛋白分析技术,但是由于它步骤繁琐、操作流程长、影响因素多,所以,导致我们在做实验时会遇到各式各样的问题。今天我们总结了一些WB实验中经常遇到的各种“奇葩”条带问题,并为你推荐了常用的解决方法,希望对大家有所帮助。
一、 目标条带没有信号
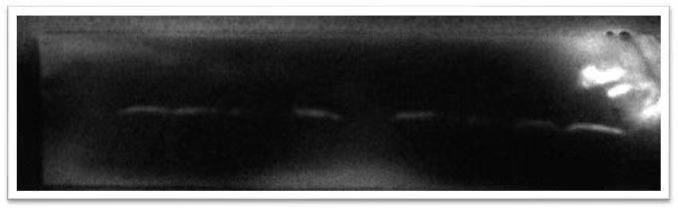
|
原因分析 |
解决方法 |
|
样品中可能含有蛋白酶,使蛋白样品分解成小分子。 |
添加蛋白酶抑制剂。 |
|
目标蛋白浓度过低(低于检测下线)。 |
加大上样量或提高目标蛋白浓度。 |
|
转膜时间太短导致目标蛋白没有充分转移到膜上,或者转膜时间过长导致样品转穿。 |
控制转膜时间并选择适合的转印膜。 |
|
一抗的特异性不佳,导致一抗无法识别目标蛋白。 |
选用高品质抗体。 |
|
一抗反复使用后导致效价降低,尽管还能与目标蛋白连接,但连接蛋白的数量太少。 |
一抗不宜反复使用。 |
|
洗脱过渡导致与一抗相结合的目标蛋白被洗掉。 |
洗脱时间的时间和频率应有效控制,一般建议3次10分钟。 |
二. 图片背景过高,难以分辨条带
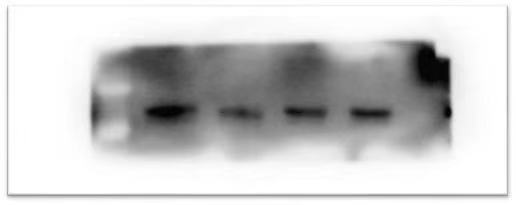
|
原因分析 |
解决方法 |
|
一抗浓度太高,导致抗体非特异性结合。 |
降低一抗浓度。 |
|
洗膜的时间和次数不够,导致其他蛋白没有清洗干净。 |
提高洗脱时间和频率。 |
|
封闭物用量不足。 |
提高封闭物浓度,孵育时保证封闭液完全浸没转印膜。 |
|
封闭物使用不当。 |
检测生物素标记的蛋白时不可用脱脂奶粉封闭。 |
|
封闭时间不够。 |
室温37度封闭1小时以上,4度封闭过夜。 |
|
一抗稀释度不适宜。 |
对抗体进行滴度测试,选择最适宜的抗体稀释度。 |
|
一抗孵育的温度偏高。 |
建议4℃结合过夜。 |
三、 膜上出现黑点和黑斑
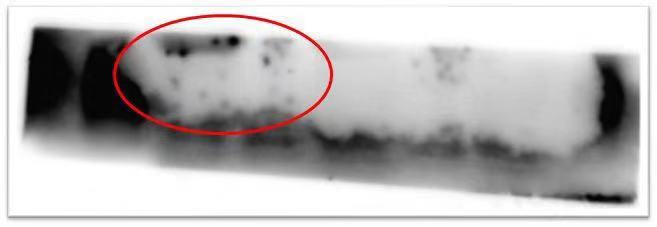
|
原因分析 |
解决方法 |
|
膜上其他部位与一抗或二抗非特异性结合,配置的封闭液可能没有完全溶解,使不容颗粒附着在膜上从而导致发光时候膜上形成黑点。 |
配置封闭液后最好静止一下,封闭牛奶一定要纯,封闭结束之前要清洗三遍之后再加一抗。 |
|
抗体与封闭试剂反应。 |
使用前过滤封闭试剂。 |
|
HRP 偶联二抗中有聚集体。 |
过滤二抗试剂,去除聚集体。 |
四、 出现非特异性条带

|
原因分析 |
解决方法 |
|
一抗非特异性与蛋白结合,此种情况大多数情况是因为一抗特异性不好。 |
更换一抗。 |
|
目的蛋白有多个修饰位点,有些一抗还能结合其他蛋白的结合位点。 |
更换一抗品种。 |
|
蛋白样品降解,蛋白酶将目标蛋白分解成若干个蛋白,而这些蛋白同样可以被一抗识别。 |
添加蛋白酶抑制剂。 |
五、条带中出现整条白色空斑

|
原因分析 |
解决方法 |
|
过高的蛋白上样量或一抗和二抗浓度过高都会促使底物过快的消耗,导致我们在做化学发光检测时,发光底物已经消耗殆尽而形成空斑。 |
减少蛋白上样量、稀释一抗和二抗的浓度。 |
六、条带中出现白圈
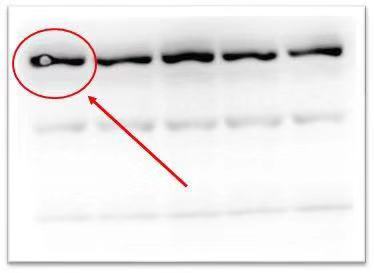
| 原因分析 | 解决方法 |
|
转膜时候,膜与胶之间有气泡。转膜时候,膜与胶之间有气泡。转膜时候,膜与胶之间有气泡。转膜时候,膜与胶之间有气泡。转膜时候,膜与胶之间有气泡。转膜时候,膜与胶之间有气泡。转膜时候,膜与胶之间有气泡。转膜时候,膜与胶之间有气泡。转膜时候,膜与胶之间有气泡。 |
制作“三明治”时,注意赶走气泡。通常将电转液倒入一个盘子里,液体高度与第一层滤纸齐平,然后往滤纸上浇一些转膜液,把电泳胶用清水清洗后平铺在滤纸上,随后在确认滤纸与胶之间无气泡后,再往胶上浇一些电转液,之后用双手的拇指和食指轻轻夹住PVDF膜两侧中间,使膜成U型,再将U型底部接触到胶的中间,慢慢往两边放下膜,这样可以减少气泡。上层滤纸同样用U型的放置方法,可以用玻璃棒贴实一下,然后盖上海绵垫。 |
七、 条带拖尾
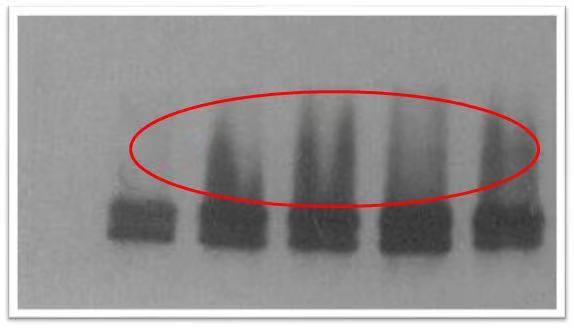
| 原因分析 | 解决方法 |
|
这种情况很容易出现,因为导致条带拖尾的原因很多,可能性较大的是一抗浓度太高,作用时间太长或蛋白量过大。 |
根据情况调整蛋白量,同时降低一抗的浓度,缩短一抗的时间。 |
八、条带变形
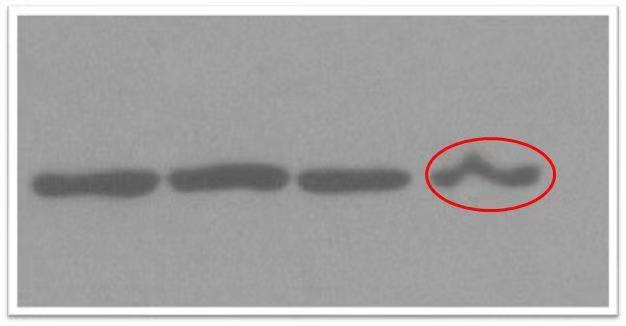
|
原因分析 |
解决方法 |
|
胶体中存在气泡,或不溶性杂质,胶不均不平整。 |
配胶时用的小烧杯,水,SDS,tris等等干净无杂质。贴边角加入液体,凝固时避免大幅度动作触碰。 |
九、条带呈哑铃装

| 原因分析 | 解决方法 |
|
出现哑铃装条带的问题,最大的可能性就是胶没有配置好,胶凝固后不均一。另外还有一种可能就是样品中含有太多杂质,没有离心下来,然后杂质沉淀在孔的中间,蛋白被挤到两边。 |
把胶配好,不合格的胶坚决不能用。 |
十、最边缘条带弯曲

| 原因分析 | 解决方法 |
|
电泳电流不均一。 |
换电泳槽,或者不使用两边的孔。 |
十一、背景非均一性
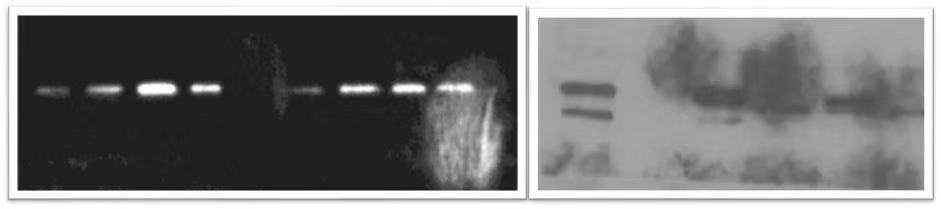
| 原因分析 | 解决方法 |
|
膜可能干过。 膜可能干过。 膜可能干过。 膜可能干过。 膜可能干过。 膜可能干过。 膜可能干过。 膜可能干过。 |
在每一步的操作过程中,都需要注意不要让膜干掉,确保蛋白面不要被风干很长时间,一定要用不漏水的封闭盒并盖上盖子,防止过夜16个小时液体流失。 |
十二、 条带呈“微笑”或“倒微笑”状![]()
| 原因分析 | 解决方法 |
|
条带呈“微笑U”状,凝胶冷却不均一,电泳槽老化。 |
更换电泳槽。 |
|
条带呈“倒微笑∩”装,凝胶左右两头没有凝固好。 |
重新制胶。 |
十三、其他问题
| 原因分析 | 解决方法 |
|
蛋白分子量偏高或者偏低。 |
可能是胶的浓度与目的蛋白的浓度不对应,比如说100KD的蛋白你用12%的胶跑,或者说20KD的蛋白你用6%的胶跑。 |
|
蛋白质降解。 |
蛋白质降解后很可能会在比原来位置低的地方出现主带,然后会出现一些其他带,最主要特点是所有的条带比正常的都低,并且条带模糊不清晰。 |
|
所有条带连成一片没有间隔。 |
原因最可能是上样量过多,其次是样品弥散(比如电泳长时间停止样品弥散)。 |
以上是我们对WB条带出现各种状况及解决方法的一个总结,希望可以对大家有所帮助。如果各种原因都试变了,还是做不好WB实验怎么办?
推荐——Elabscience整套的WB试剂盒!
Elabscience结合客户需求,特推出Western Blot检测试剂盒,为您顺利完成Western Blot实验提供整套解决方案,免去你每个步骤的试剂都要一一去采购、配比、验证可用性等等,也不用每一步流程都需要反复去摸索合适的实验条件,极大的减少了人为差异性,再也不担心出现各种“奇葩”条带了!
这个试剂盒里面包含了完整的经典WB所需全套试剂,从蛋白提取到ECL底物曝光在内,应有尽有。
并且还有两种孔径的PVDF膜可供选择,整个配套的试剂盒可供完成5块凝胶(约50个样本)对应的 WB 试验,一点儿都不浪费!
另外,还额外赠送一支20µL的Goat Anti-Mouse IgG(H+L)-HRP,真的很良心了,
跑出来的图,也是真心漂亮:
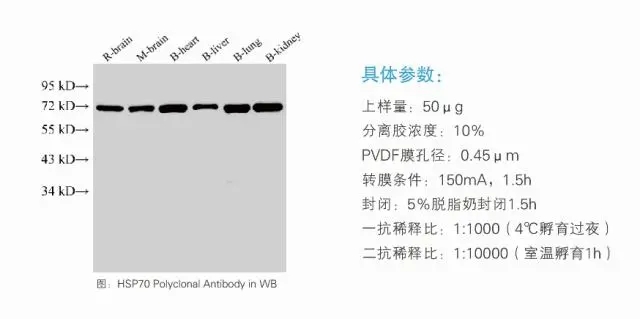
跑出漂亮条带的秘诀,你学会了吗?
温馨提醒:
如果您想了解或者购买WB试剂盒的话,可点击右方的在线咨询,专业的技术人员将为您提供解答。