流式TUNEL法使得大规模、快速、准确地定量分析细胞凋亡成为可能。然而,在实际操作过程中,大家可能会遇到一系列问题,今天就带大家来进行流式TUNEL异常结果分析。
细胞在发生凋亡时会激活一些DNA内切酶,这些内切酶可以使染色体DNA双链或者单链断裂而产生大量的粘性3'-OH末端,细胞经过固定破膜后,TdT酶(脱氧核糖核酸末端转移酶)将荧光标记的dUTP连接到因DNA断裂而暴露的3'-OH末端,通过流式细胞仪检测dUTP偶联物发出的荧光信号,从而来检测晚期凋亡。
与原位TUNEL相比,流式TUNEL灵敏度高,操作简单,能进行定性定量分析,尤其对于贴壁细胞来说,流式TUNEL可以收集到细胞上清中的晚凋细胞进行检测,结果更准确,因此,流式TUNEL成为了检测细胞凋亡最常用的方法之一。
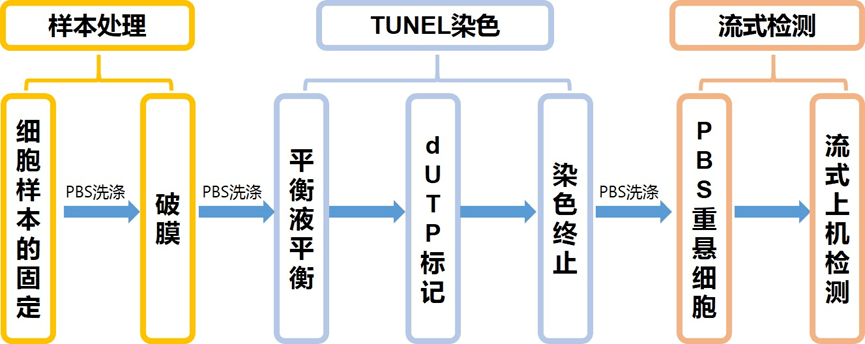
流式TUNEL染色步骤
首先我们要了解一下流式TUNEL染色步骤:
流式TUNEL分组设置
此外,还需要做一些分组设置:
|
分组 |
分组设置 |
目的 |
|
阴性对照(必做) |
不加TdT酶,其余操作和实验组相同 |
①实验组的阴性设门参照 ②排除由于细胞本底、细胞自身凋亡及操作过程等原因产生的背景荧光的影响 |
|
实验组(必做) |
除了阳性对照和阴性对照,待检测的所有样本均是实验组 |
待检测的各实验组 |
|
阳性对照(选做) |
用DNase酶处理或者用常用有效药物诱导细胞凋亡 |
用来验证本次实验操作和试剂盒有无问题 |
流式TUNEL异常结果分析
在进行流式TUNEL实验时,大家可能会遇到染色结果异常的问题,包括凋亡诱导组未检测到凋亡细胞群、细胞碎片较多、正常组阳性率高等,今天带大家来逐个击破。
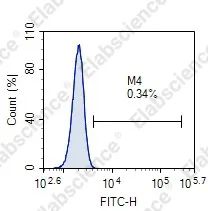
01
|
异常原因 |
解决方案 |
|
细胞诱导凋亡失败 |
设置不同药物浓度梯度和诱导时间,找到合适的诱导条件 |
|
细胞数目较多,细胞破膜不彻底 |
增加Permeabilization Buffer的剂量,合理充分破膜 |
|
洗涤液中含有EDTA等螯合剂,导致TdT酶失效 |
使用不含EDTA的PBS洗涤 |
|
检测时间过长导致荧光淬灭 |
标记完的细胞1 h内尽快上机检测 |
|
细胞数目较少或者细胞沉淀导致采集到的信号较弱 |
放置过久的样本上机前先混匀后检测 |
|
标记时间过短 |
一般37°C孵育60 min |
|
检测通道选错 |
选择正确的检测通道 |
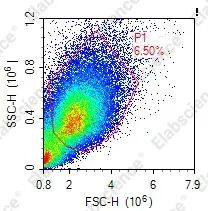
02
|
异常原因 |
解决方案 |
|
固定不充分,破膜导致细胞破碎 |
适当延长固定的时间,充分固定细胞后再破膜 |
|
破膜时间过久,破膜温度过高 |
破膜时间应控制在10 min左右,最长不超过15 min,并于冰上破膜 |
|
细胞样本收集后未及时固定导致细胞状态变差 |
样本及时使用固定液室温固定1 h,离心洗涤后PBS(含1%BSA)重悬,4℃保存,3天内检测 |
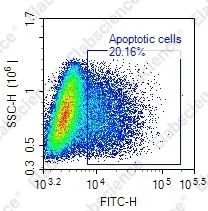
03
|
异常原因 |
解决方案 |
|
非凋亡引起的阳性率升高,如坏死细胞、退化的细胞、正在经历 DNA 修复的细胞、被机械力破坏的细胞、高速分裂和增殖的细胞 |
配合其他的检测手段进行关联分析,如测定细胞的增殖速率,选定最佳的检测时期 |
|
标记时间过长导致非特异性背景增加 |
标记工作液现配现用,标记条件37℃ 60 min |
|
细胞培养密度过高,接触抑制导致细胞死亡 |
调整适宜的细胞培养密度,检测当天细胞密度一般不超过培养皿的80% |
以上就是为大家整理的流式TUNEL常见问题分析