基本信息:
题目:NanoRNP Overcomes Tumor Heterogeneity in Cancer Treatment
中文题目:NanoRNP攻克了癌症治疗中肿瘤异质性难题
期刊:Nano Letters
IF (2018):12.279
第一作者单位:南开大学
通讯作者单位:南开大学,天津医科大学,哈尔滨医科大学
使用Elabscience产品:
|
产品货号 |
应用 |
检测靶标 |
种属 |
测定样本 |
|
ELISA |
免疫球蛋白G(IgG) |
小鼠 |
血浆 |
|
|
ELISA |
免疫球蛋白E(IgE) |
小鼠 |
血浆 |
|
|
ELISA |
免疫球蛋白M(IgM) |
小鼠 |
血浆 |
|
|
ELISA |
白介素6(IL-6) |
小鼠 |
血浆 |
|
|
ELISA |
γ干扰素(IFN-γ) |
小鼠 |
血浆 |
|
|
ELISA |
肿瘤坏死因子α(TNF-α) |
小鼠 |
血浆 |
|
|
E-EL-M0836 |
ELISA |
核因子κB亚基p105(NF-κB p105) |
小鼠 |
血浆 |



研究背景
肿瘤发生过程中不同肿瘤细胞亚群的积累,使得肿瘤异质性已成为传统肿瘤治疗失败的重要原因之一。而由于肿瘤生长过程中基因突变的多样性,多种药物的联合治疗在对抗异质性肿瘤的进程中,只能取得十分有限的效果。
大多数恶性肿瘤都伴随肿瘤异质性,给肿瘤治疗策略的制定带来极大的挑战。常规肿瘤治疗如化疗、免疫治疗、基因治疗等在治疗初期可能获得显著效果,但肿瘤细胞亚群能够对这些治疗产生抵抗并促使肿瘤复发,导致肿瘤治疗失败。
为了克服肿瘤异质性并减少复发,近年来,已开发出多种药物联合疗法来同时抑制多种肿瘤细胞亚群以增强治疗效果并改善预后,但是,肿瘤生长过程中基因突变的随机性和多样性使得几乎不可能通过药物联合治疗的方式来覆盖所有肿瘤细胞亚群。此外,药物之间不同的药代动力学(Pharmacokinetic, PK)和体内分布进一步增加了药物组合的复杂性。尽管药物传递系统(Drug Delivery Systems, DDS)的发展可以通过将多种药物装入同一系统中来解决PK和体内分布差异问题,但许多常见的抗肿瘤药物如化疗用药和基因用药因其不相容性导致无法混合同时给药,需要设计特殊的DDS来保证其抗肿瘤疗效。这些问题对基于传统药物开发策略来治疗异质性肿瘤提出了巨大的挑战。因此,有必要研发一种更加新颖且实用的抗癌策略来攻克恶性肿瘤治疗过程中的肿瘤异质性难题。
得益于最新研究开发的基因编辑技术- CRISPR)/CRISPR-相关蛋白9(Cas9),给癌症治疗提供了新的平台。基于CRISPR/Cas9的癌症疗法的一个重要的优势是能够通过简单的改变sgRNA来治疗不同类型的癌症,更为重要的是,这种能力使CRISPR/Cas9系统通过传递Cas9和sgRNA的组合来抑制异质性肿瘤中多个细胞亚群,为有效治疗异质性肿瘤提供了潜在的通用平台,但相关的研究目前尚未报道。
实验思路:
本文主要通过应用强大的Cas9基因编辑技术结合携带靶向STAT3和RUNX1的sgRNA,建立纳米-Cas9核糖核蛋白系统(nano-Cas9 ribonucleoprotein system, nanoRNP),并建立体外异质性肿瘤细胞亚群模型及小鼠异质性肿瘤模型,通过细胞免疫荧光、免疫组化、Western blot、血液炎性细胞因子ELISA定量等实验手段,来验证携带特定sgRNA的nanoRNP是否能够安全可靠地实现对异质性肿瘤的有效抑制。
实验设计:
- 沉默U87MG细胞的STAT3和RUNX1基因并筛选出稳定的U87MGLV-STAT3-mcherry和U87MGLV-RUNX1-GFP细胞系,培养两种细胞系并建立体外异质性肿瘤细胞亚群模型
- 制备携带靶向STAT3和RUNX1 sgRNA的nanoRNP复合物,分别检测nanoRNP-STAT3, nanoRNP-RUNX1, nanoRNP-STAT3+RUNX1对体外异质性肿瘤细胞亚群的抑制作用
- 皮下注射两种细胞系,建立小鼠异质性肿瘤模型,随后静脉注射nanoRNP复合物,分别检测nanoRNP-STAT3, nanoRNP-RUNX1, nanoRNP-STAT3+RUNX1对体内异质性肿瘤的抑制作用
- 通过ELISA方法检测血浆细胞炎性因子的表达变化,并对模型小鼠的主要组织(心脏、肝脏、肾、脾、肺)进行蛋白印迹(Western Blot)和组织学分析(histology analysis),综合评估nanoRNP在体内使用的安全性。
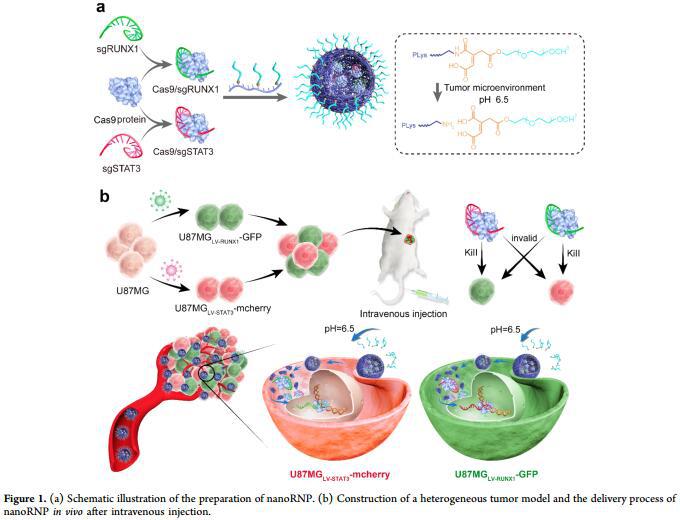
图a显示nanoRNP的制备过程
图b显示小鼠体内异质性肿瘤造模过程及nanoRNP在体内的传递过程
重要研究成果:
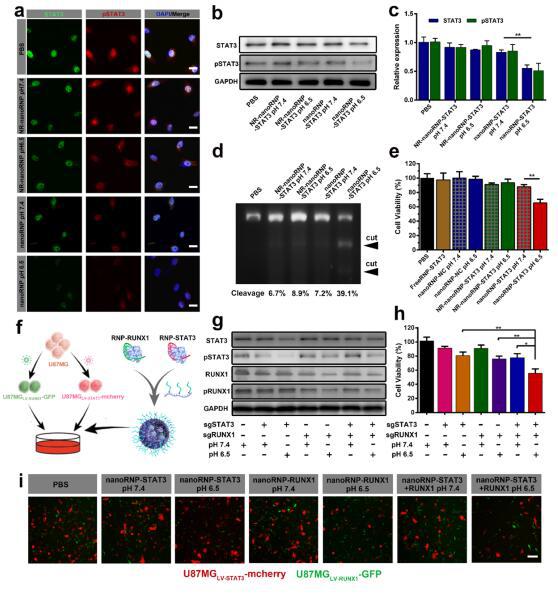
nanoRNP在体外异质性肿瘤模型中可抑制多种细胞亚群,实验结果表明nanoRNP(nanoRNP-STAT3+RUNX1)可以同时抑制异质性肿瘤模型中两种肿瘤细胞亚群的生长,而携带一种靶向基因sgRNA的nanoRNP仅能抑制其中一种对应的肿瘤细胞亚群(图g, h, i)。
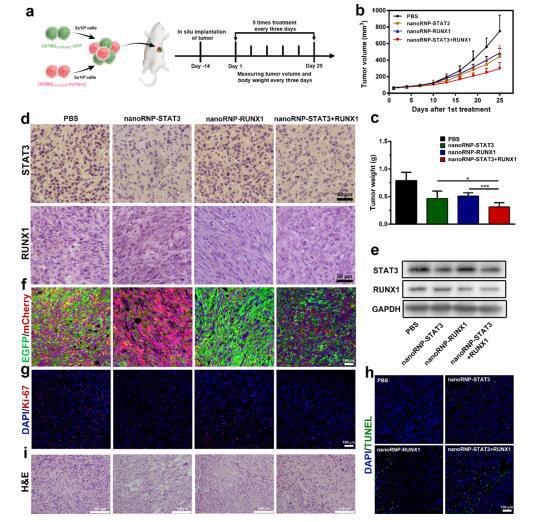
nanoRNP在异质性肿瘤模型小鼠体内能够高效抑制肿瘤,实验结果表明nanoRNP-STAT3+RUNX1可以对异质性肿瘤的生长实现最有效的抑制,而只携带一种靶向基因sgRNA的nanoRNP(nanoRNP-STAT3, nanoRNP-RUNX1)对异质性肿瘤的生长抑制效果相对较弱(图b,c)。肿瘤组织的荧光分析结果也表明nanoRNP-STAT3+RUNX1可同时抑制两种肿瘤细胞亚群(图d)。
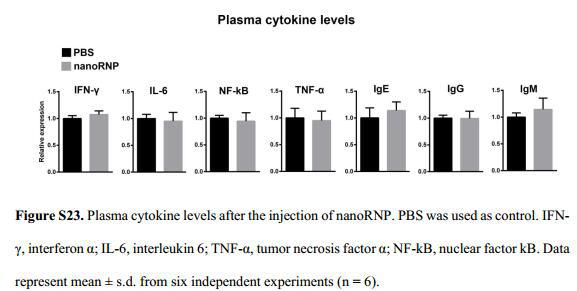
与对照组比较,没有检测到异质性肿瘤模型小鼠血浆中炎性细胞因子或免疫球蛋白表达增加,表明nanoRNP在体内具有很弱的免疫原性(图S23),WB结果中各组织中STAT3的表达没有显著变化(图S24),H&E组织学分析并未发现任何组织损伤(图S25),这些实验结果都证实nanoRNP在体内作为癌症治疗的应用是安全可靠的。
文章创新点:
- 本研究通过nanoRNP携带任意需要的靶向sgRNAs, 提供一种新型有效的抗肿瘤治疗策略来克服肿瘤异质性难题。nanoRNP是由Cas9核糖核蛋白、特定需要的sgRNAs组合以及合理设计的响应式聚合物组成,这种聚合物使nanoRNP在体内具有高循环稳定性、更强的肿瘤聚积性,并最终能在靶标肿瘤细胞中进行有效的基因编辑。
- 本研究设计的nanoRNP-STAT3+RUNX1复合物不仅能够有效地抑制体外异质性肿瘤细胞亚群的生长,而且在体内也能对异质性肿瘤的生长产生明显有效的抑制作用。
- 肿瘤异质性与癌症发展、治疗耐受、复发等密切相关,而nanoRNP为克服针对恶性肿瘤制定更为先进的治疗方案中遭遇的肿瘤异质性难题提供了可行性策略。
更多信息获取:
原文链接:https://doi.org/10.1021/acs.nanolett.9b02501
Elabscience产品:https://www.elabscience.cn