上期,给大家分享了专题内容《靶标解读丨多功能细胞因子 IL-6》(点击查看推文) ,重点介绍了IL-6的来源、作用方式与特点、介导的信号通路和在临床上的应用等。本期推文,将给大家分享另一种重要的细胞因子——TNF-α。
TNF-α简介
肿瘤坏死因子α(TNF-α)是一种连接炎症和免疫系统的关键细胞因子,分子量为17 kDa或26 kDa。TNF可由生物体内的多种细胞产生,包括活化的巨噬细胞、NK细胞和T淋巴细胞。其中,主要由巨噬细胞产生的TNF被命名为TNF-α[1],具有细胞增殖、代谢激活、炎症反应和细胞死亡等多种生物学功能。
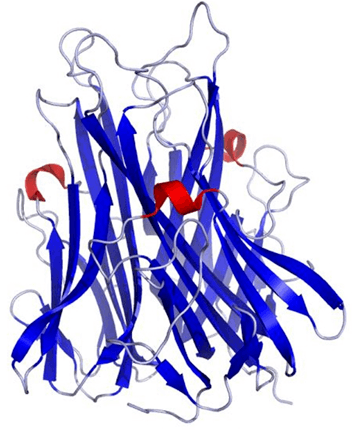
图1. TNF-α的结构示意图
TNF-α的分泌与活化
TNF-α以两种形式存在:跨膜TNF-α(tm TNF-α)和可溶性TNF-α(s TNF-α)。tm TNF-α以II型跨膜肽的形式在活化的巨噬细胞、淋巴细胞等表面表达,该肽由233个氨基酸(26 kDa)组成,然后经TNF-α转化酶处理并转化为s TNF-α,该肽包含157个氨基酸(17 kDa)[2]。两种形式的TNF-α都可以通过形成三聚体被激活,然而,不同形式的TNF-α会产生不同甚至相反的生物学结果。
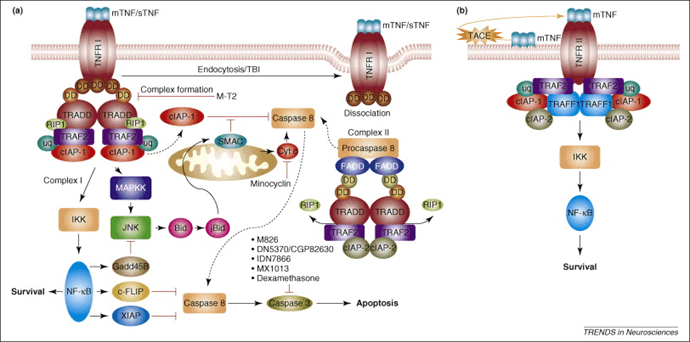
图2. TNF-α的受体信号传导
TNF-α的信号通路
TNF-α通过与其受体TNFR1(CD120a,p55)和TNFR2(CD120b,p75)结合发挥作用。TNFR1在几乎所有类型的细胞上都表达,并且可以被s TNF-α和tm TNF-α激活。TNFR2主要在免疫细胞上表达,其主要配体是tm TNF-α。s TNF-α和tm TNF-α分别优先触发TNFR1和TNFR2。这两种受体具有相似的富含半胱氨酸的细胞外亚结构。然而,它们的细胞内结构域没有同源性,并且它们激活不同的下游信号通路。
TNFR1作为死亡受体,其细胞质部分包括死亡结构域,与TNF-α激活的组织损伤相关的炎症和程序性细胞死亡主要由TNFR1介导。TNFR2不包含死亡结构域,几项研究表明,TNFR2可以极大地促进细胞的活化、迁移和增殖,并介导促进组织修复和血管生成的信号通路[3]。
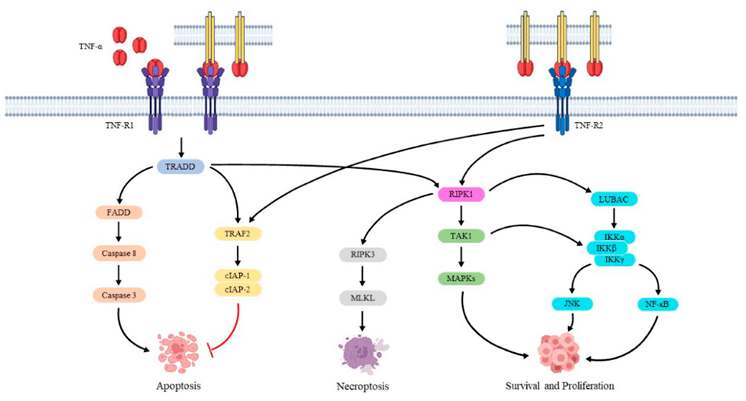
图3. TNF-α的信号通路
TNF-α的临床应用
TNF-α与痛风
痛风急性发作过程中有多种炎性细胞、炎性因子参与,其中IL-1在炎症的激活和维持中发挥了核心作用,是IL-1家族中行使生物学功能的主要炎性因子。在痛风性关节炎的发病机制中,TNF-α可引发中性粒细胞(PMN)响应单钠尿酸盐(MSU)刺激并分泌活性caspase-1,进而促进IL-1的裂解、活化,引起血管扩张并导致单核细胞和吞噬细胞的募集,从而参与炎症进程。内源性TNF-α还可增强IL-6的介导,延长核因子κB(NF-κB)抑制蛋白z(IκBz)共激活因子的合成,并维持IL-6调节区的增强子结合蛋白β(C/EBPβ)募集和组蛋白乙酰化,从而促进活化的人PMN表达IL-6[4]。
痛风或痛风性关节炎的发病机制的特点在于多种炎性细胞或因子的共同参与,TNF-α作为一种重要的免疫调节和前炎性因子,通过参与IL-1活化、增强IL-6介导的炎症反应、激活NF-κB炎症信号通路、与PMN相互作用等众多环节,诱发或加重痛风性关节炎(GA)的病理过程,并参与GA慢性期骨质破坏的发生[4]。
TNF-α与肌少症
肌肉减少症(简称肌少症)是指与增龄相关的进行性、全身肌量减少和/或肌强度下降或肌肉生理功能减退为特征的综合征。福建医科大学附属第一医院谢良地教授团队构建成功自然衰老肌少症小鼠模型之后发现,患有肌少症的老年小鼠表现出慢性低度炎症,血清TNF-α水平高的特点。该研究在细胞水平上深入探索了TNF-α调控骨骼肌细胞焦亡及介导骨骼肌细胞发生细胞凋亡与焦亡间相互转换的分子机制,为深入认识肌少症的发病机制及其治疗提供了新思路[5]。
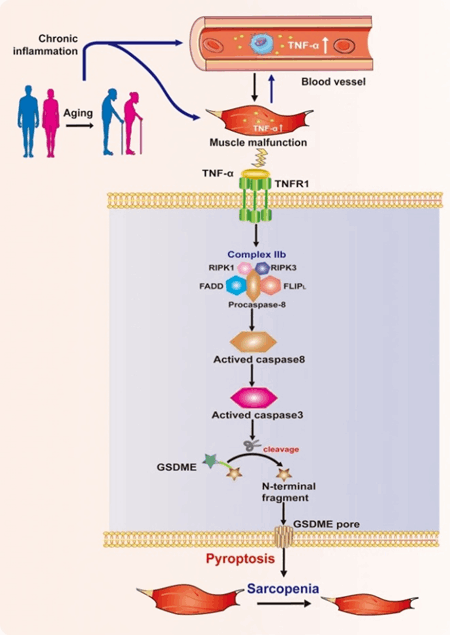
图4. 通过TNF复合物IIb调节焦下垂建立TNF-α诱导的少肌症模型
TNF-α与肿瘤免疫疾病
糖酵解的代谢重编程是恶性肿瘤的一个标志,免疫检查点阻断(ICB)等免疫治疗无效是癌症治疗中的一个主要问题。Cell Metabolism上相关研究论文中,为了更好了解肿瘤在CTL(细胞毒性T细胞)介导杀伤中的内在抗性机制,对癌细胞系中进行了全基因组CRISPR筛选,以测试它们与CTL共培养时的扰动效应抗性。作者发现缺乏两种重要的糖酵解酶,Glut1(葡萄糖转运蛋白1)和Gpi1(葡萄糖-6-磷酸异构酶1),导致CTL对肿瘤细胞的杀伤增强。从机制上讲,Glut1失活导致代谢重新布线向氧化磷酸化,从而产生过量的活性氧(ROS)。积累的ROS以Caspase-8和FADD依赖的方式增强TNF-a介导的肿瘤细胞死亡。Glut1基因和药理学失活使肿瘤对抗肿瘤免疫增敏,并通过TNF-a途径与抗PD-1治疗协同作用。肿瘤内部糖酵解和TNF诱导的杀伤之间的机制相互作用为增强抗肿瘤免疫提供了新的治疗策略[6]。
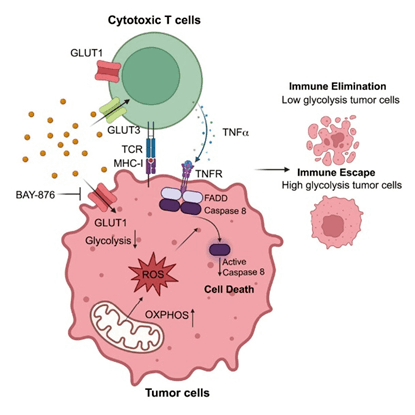
图5. 肿瘤有氧糖酵解通过调节TNF-α对T细胞介导的旁观者杀伤来实现免疫逃避
TNF-α抑制剂
TNF-α的异常产生与多种慢性免疫炎症性疾病有关,如类风湿关节炎(RA)、炎症性肠病(IBD)、银屑病(PS)、银屑病关节炎(PsA)及自身免疫性葡萄膜炎,因此后期TNF-α抑制剂首先应用于这几种疾病[7]。已进入临床使用的TNFα抑制剂包括英夫利昔单抗、阿达木单抗、依那西普、戈里木单抗和赛妥珠单抗五种进口品种药物,以及益赛普、强克、安伯诺、安健宁四种国产品种药物。
其作用机制主要分为两类:
中和TNF-α,阻断TNFR介导的效应;
主要由单克隆抗体类TNF-α抑制剂结合携带tmTNF-α的细胞,诱导反向信号传导和细胞毒作用。
抗TNF-α治疗作为传统合成药物治疗失败后使用的第一个生物靶向药物,为治疗慢性炎症性疾病奠定了基础,也给其他靶向治疗药物的发展提供了很好的经验。目前抗TNF-α药物的使用还存在着许多未被满足的需求,比如提示药物有效的生物标记物、生物类似药的疗效和副作用等。
以上分享给大家的关于肿瘤坏死因子-α的相关知识。