本文我们将对程序性死亡的三种类型即细胞凋亡、细胞坏死、细胞焦亡做一个简单的总结,并着重介绍在凋亡和焦亡过程中发挥重要作用的Caspase家族,以及Caspase酶活性检测(分光光度法)常见的问题和解决方案。
我们先来简单回顾下Caspases蛋白酶家族参与的细胞凋亡和焦亡的相关内容:
|
类型 |
细胞凋亡 |
细胞坏死 |
细胞焦亡 |
|
相同点 |
都是程序性死亡方式 |
||
|
诱因 |
辐射,毒素,缺氧,内质网应激,DNA损伤等 |
炎症因子,细菌,病毒,免疫细胞 |
炎症因子,毒素,病毒,细菌,免疫细胞等 |
|
细胞形态变化 |
缩小 |
细胞膨大,变形 |
细胞膨大较小,气泡状突起 |
|
细胞膜变化 |
膜结构完整 |
膜结构破裂 |
膜结构破裂 |
|
DNA变化 |
DNA断裂较早,非随机断裂为180-200 bp及其整数倍的DNA片段 |
DNA随机断裂,发生较迟(溶解后断裂) |
DNA随机断裂,发生较早 |
|
生理意义 |
单个细胞死亡,巨噬细胞或邻近细胞吞噬,无炎症反应 |
细胞群体死亡,巨噬细胞吞噬,明显的炎症反应 |
Caspases家族参与,介于凋亡和坏死之间 |
|
检测方法 |
流式细胞术、酶活性检测(Caspases活性)、免疫学方法 |
电镜检测、生化检测 |
流式细胞术、酶活性检测(Caspases活性)、免疫学方法 |
|
信号通路 |
内源性通路: Cyto C-AIF-Cas 9-Cas 3; 外源性通路: Cas8-Cas3 |
TNF/TNFR1-TRADD/RIP1/RIP3-MLKL |
依 赖 Caspase 1 的 经 典 通 路 : Caspase 1/GSDM途径; 依 赖 Caspase 4/5/11 的 非 经 典 通 路:Caspase4/5/11/GSDM途径 |
|
执行者 |
Caspase-3 切割DNA |
MLKL 膜上打孔 |
GSDM 膜上打孔 |
接下来,我们来了解下Caspases蛋白酶家族的成员,Caspases即半胱氨酸蛋白酶家族作为程序性细胞死亡信号通路的关键调控环节,发挥着举足轻重的作用。
细胞凋亡的过程实际上是Caspase被活化并发挥凋亡蛋白酶的酶切功能的级联反应。Caspases蛋白酶家族存在于胞浆中,它们同源性很高,结构相似,均含有一个半胱氨酸激活位点,特异地断开天冬氨酸残基后的肽键,目前被发现的Caspases有14种,哺乳动物Caspases蛋白酶家族根据结构和功能,可以分为三大类:
|
种类 |
分组 |
功能 |
|
促凋亡Caspases |
启动者:Caspase-2,8,9,10 |
以级联放大的方式对胞内蛋白进行高效切割,最终导致细胞凋亡 |
|
效应者:Caspase-3,6,7 |
||
|
促炎性Caspases |
Caspase-1,4,5,11,12,13 |
先天性免疫应答激活期间,促炎性Caspases介导特异性细胞因子(Cytokines)的成熟,如Pro-IL-1β和Pro-IL-18,形成有活性的IL-1β和IL-18;也参与细胞的焦亡过程 |
|
角化细胞分化Caspases |
Caspase-14 |
参与角化细胞的分化,但不会在炎症或细胞凋亡中发挥重要作用 |
Caspases酶在细胞中常常以酶原的形式存在,不具有剪切活性,被激活后以剪切体的形式存在。本文着重介绍使用酶标仪通过Caspases酶活性检测试剂盒(分光光度法)检测Caspases活性体的方法,其原理主要是基于Caspases可以催化特异性底物Ac-XXXD-pNA产生黄色的pNA (p-nitroaniline), pNA在405 nm附近有强吸收,从而可以通过测定吸光度来检测Caspases的活性。
主要原理图如下所示:
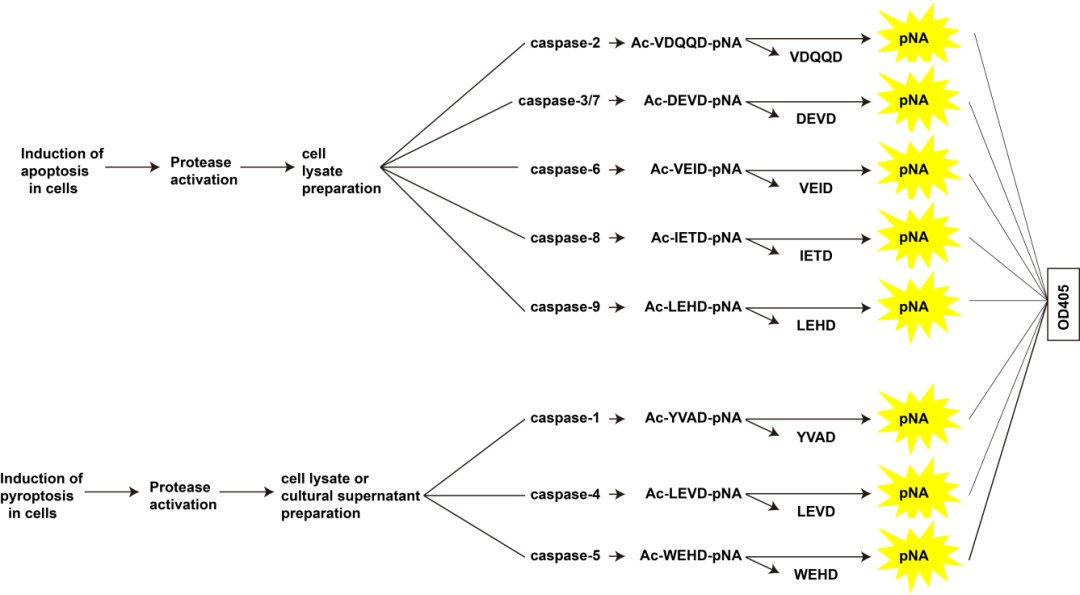
Caspase酶活性检测试剂盒(吸光法)的检测流程主要包括样本的前处理、样本的裂解、酶活的检测三大块,针对该检测流程,汇总了以下常见问题和解决方法:
样本前处理过程中存在的问题和解决办法
|
常见异常 |
可能的原因 |
解决方案 |
|
测定A405值偏低或无反应 |
凋亡现象不明显或者凋亡晚期收细胞样本 |
Caspase-3等在细胞凋亡早期活化程度最高,随着凋亡的进行,活性降低,可设置药物处理的时间梯度,或者根据常见的阳性对照模型设置对照检测 |
|
细胞诱导时的密度太大 |
降低诱导时细胞的密度,摸索最佳诱导密度,推荐诱导密度为5~10*105个/mL |
|
|
药物或者试剂没有激活Caspases相关的信号通路,而是通过其他途径引起的凋亡或焦亡 |
确认药物或者试剂的有效性及诱导原理 |
|
|
样本保存不当 |
组织或者细胞样本收集后不能裂解或检测酶活时,立即-80℃或者液氮冻存样本,以保证最大程度的维持酶活 |
|
|
测定A405值偏高 |
细胞处理试剂或者药物有颜色,且在405 nm波长有吸收峰 |
增加细胞离心洗涤的次数,设置细胞处理试剂的空白对照,最终实验结果减去药物试剂的影响 |
样本裂解过程中存在的问题和解决办法
|
常见异常 |
可能的原因 |
解决方案 |
|
测定A405值偏低或无反应 |
细胞数目太少,裂解液太多 |
增加细胞的数量,每100万细胞加入50~100 μL裂解液 |
|
检测总蛋白量较低 |
使用Bradford法测浓度,提高蛋白检测的总量,可以进行预实验检测,检测总蛋白不低于50 ug |
|
|
样本裂解温度较高,DTT失活,Caspase酶失活 |
DTT试剂和细胞裂解过程在冰上进行,每10 min进行涡旋混匀一次,充分保证酶活 |
|
|
样本处理不佳,导致细胞降解,Caspase酶失活 |
细胞处理后立即放入-20 ℃(1个月)或者-80 ℃(2个月)保存备用,规定时间内进行检测 |
|
|
检测结果和其他检测途径不一致 |
各组总蛋白检测量不一致 |
使用Bradford法浓度,调整各组总蛋白检测量一致 |
样本检测过程中存在的问题和解决办法
|
常见异常 |
可能的原因 |
解决方案 |
|
测定A405值偏低或无反应 |
波长范围选择错误 |
最佳检测波长为405 nm,若仪器条件不满足,可选择400-450 nm范围 |
|
37℃孵育时间过长 |
适当延长37℃孵育时间,建议最佳孵育时间为1-2小时内,随着时间延长,Control组的背景数值会逐渐增大 |
|
|
测定A405值偏高 |
检测样本中有较多气泡 |
排除气泡后再检测 |
|
检测结果和其他检测途径不一致 |
样本混匀时液体溢出 |
小心处理样本,避免样本混匀时导致样本溢出孔板,影响最终各组读值 |
其他因素引起的问题和解决办法
|
常见异常 |
可能的原因 |
解决方案 |
|
测定A405值偏低或无反应 |
试剂盒保存条件不佳,或者失效 |
按照说明书保存试剂,并在有效期内使用 |
|
裂解液或者反应液污染,Ph改变 |
裂解液和反应液妥善保管,避免其他试剂污染 |
|
|
使用前解冻后试剂未混匀 |
解冻溶解后的反应液和裂解液以及底物要先吹打混匀,再使用 |
|
|
测定A405值偏高 |
使用回收的96孔板中有杂质附着,导致结果偏高 |
建议使用新的一次性96孔板 |
|
Caspase-2的底物选择问题 |
Ac-VDQQD-pNA和Ac-VDVAD-pNA哪个底物更好 |
Caspase-2剪切底物需要一个五肽序列(XDxxD), 可以结合到Caspase-2的二聚体结合槽中,VDVAD满足条件,但是不够特异性,也可被Caspase-3剪切,VDQQD特异性更好些,只满足Caspase-2的剪切 |
综上所述,细节决定成败,把各个实验环节的细节把控到位,Caspases酶活性检测(吸光法)就可以万无一失,获得最准确的实验数据。