01 铁死亡简介
铁死亡(Ferroptosis)是一种独特的程序性细胞死亡方式,在细胞形态、代谢和分子生物学方面,均有别于其他已知的细胞死亡方式。
铁死亡与多种生理和病理过程有关,通过适当的手段,激活或抑制铁死亡,可以干预疾病的发展,如:诱导癌细胞铁死亡可能成为一种极具前景的癌症治疗方法。这一方法尤其适用于那些对传统治疗方法产生抗性的肿瘤。
02 铁死亡的研究思路
铁死亡研究如此热门,在课题设计过程中,会涉及哪些方向的实验呢?我们以一篇文献为例:
2022年3月,Cell Death & Differentiation杂志(IF=15.828)刊登了文章:Long noncoding RNA NEAT1 promotes ferroptosis by modulating the miR-362-3p/MIOX axis as a ceRNA。研究发现,长非编码RNA(lncRNA)NEAT1,通过调节miR-362-3p和MIOX,在铁死亡中发挥了重要作用。(DOI:10.1038/s41418-022-00970-9)
研究步骤如下:
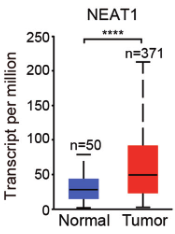
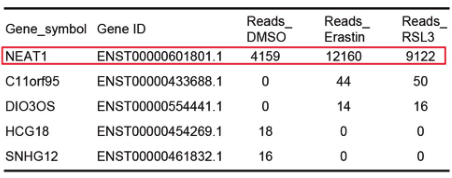
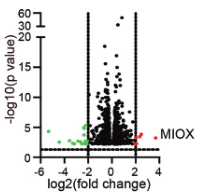
(1)鉴定与铁死亡有关的lncRNA,采用铁死亡诱导剂(Erastin和RL3)处理肝癌细胞系HepG2,通过RNA-Seq分析,筛选表达提升最显著的lncRNA,即NEAT1。
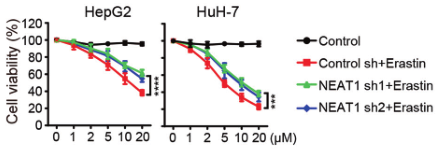
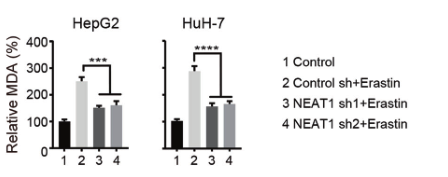
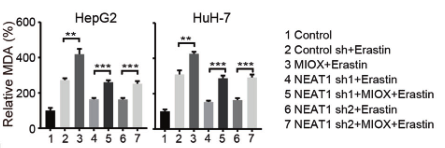
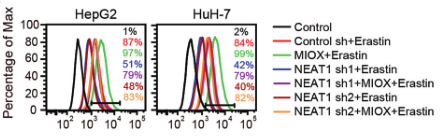
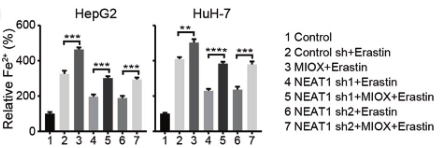
(2)为了验证NEAT1在铁死亡中的作用,研究人员在敲除HepG2和HuH-7细胞的NEAT1后,用铁死亡诱导剂处理细胞,检测铁死亡的关键指标(MDA、ROS和Fe2+),发现其含量均显著降低,说明敲除NEAT1能够抑制铁死亡的发生,NEAT1能够促进Erastin和RSL3诱导的铁死亡。
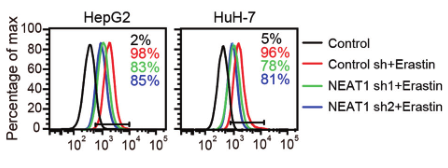
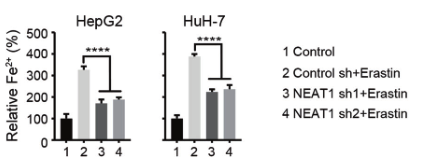
(3)为了探究NEAT1是如何促进铁死亡的,研究人员进行了大量验证,发现MIOX是NEAT1的靶基因,Eastin和RSL3均不能诱导NEAT1敲除细胞中的MIOX上调。
在缺乏NEAT1的细胞中超表达MIOX后,对铁死亡的关键指标进行检测,结果显示MDA、ROS和Fe2+的含量增加,验证了MIOX的过表达会引发NEAT1缺乏的细胞发生铁死亡。
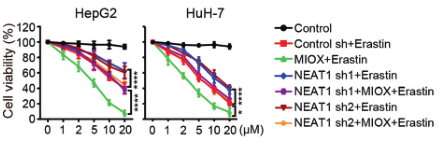
(4)为了进一步探索MIOX如何调控铁死亡,研究人员用erastin和RSL3处理过表达MIOX的细胞后,对Fe2+、GSH、NADPH指标进行检测,发现 Fe2+含量显著升高,GSH、NADPH指标降低,而在敲除MIOX的细胞中得到了相反的结果。结果表明:MIOX通过调节细胞内亚铁离子、GSH和NADPH水平来调控铁死亡。
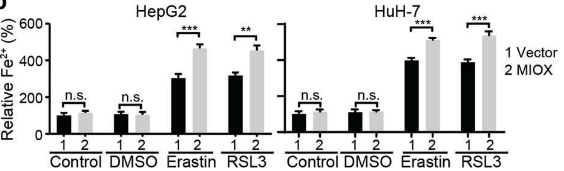
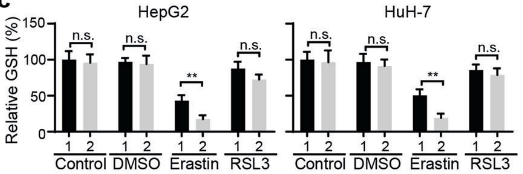
图1 图2
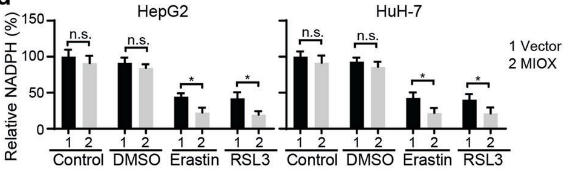
图3
(5)进一步研究NEAT1如何调控MIOX表达诱导铁死亡,研究人员使用靶点预测工具比较发现了miR-362-3p,通过荧光素酶活性测定、western blotting、铁死亡生化指标检测等实验,证明了NEAT1通过miR-362-3p来调控MIOX表达。
(6)研究人员进行了NU/NU裸鼠体内实验,通过皮下注射NEAT1,稳定过表达的HepG2和HuH-7细胞,验证了NEAT1高表达的肿瘤体积明显小于使用相同药物治疗的对照组,并总结出如下信号通路:

03 总结
我们查阅大量文献后发现,目前铁死亡的研究方法基本遵循:表型-蛋白表达-分子表达-基因敲除/过表达逆转表型的研究思路,一般根据形态特征检测、基因表达检测、蛋白水平检测及生化特征指标检测等四个主要方面,来探索铁死亡的机制及作用。
与经典的Caspase-3和Annexin-V判定细胞凋亡不同,到目前为止,仍然没有判定铁死亡的“金指标”,即决定性的代谢指标。
要判定一个细胞死亡模型是否为铁死亡,首先需要检测相关的指标(如亚铁、MDA、GSH/GSSG、GPX4、SLC7A11蛋白、PCG2等)是否出现变化,再使用铁死亡的抑制剂实验,观察是否能逆转细胞死亡和相关指标的变化。
综上,探索铁死亡的决定性指标,及开发定位更加精确、灵敏度更高的检测方法(如直接检测线粒体中的铁含量),仍然是众多铁死亡领域科研工作者关注的热点。
Elabscience®潜心钻研,自主研发了细胞铁、活性氧、脂质过氧化物、谷胱甘肽等系列铁死亡相关研究指标的检测试剂盒,助力铁死亡研究,详情查看铁死亡专题页面