01 铜死亡简介
2022年3月17日,《Science》期刊上刊登了来自美国哈佛大学和麻省理工学院布罗德研究所TODD R. GOLUB团队发表的研究性论文Copper induces cell death by targeting lipoylated TCA cycle proteins,正式命名了一种新的细胞死亡方式——铜死亡(Cuproptosis)。

文章主要得出以下几个结论:
1. 铜死亡是一种新的细胞死亡机制,与蛋白质脂酰化相关;
2. 铜与TCA循环的脂酰化成分直接结合,使脂酰化蛋白聚集和铁硫簇蛋白丢失,进而引起蛋白质毒性应激并最终导致细胞死亡;
3. FDX1是蛋白质脂酰化的上游调节因子,FDX1和蛋白质脂酰化是铜死亡的关键调节因子。
02 研究进展
关于铜死亡的研究正逐渐兴起,即将成为一个新的热门研究方向,这是继铁死亡之后的又一个金属离子依赖性的细胞死亡机制。截止2023年3月底,以“Cuproptosis”为关键词的研究型论文已发表了近300篇。
目前,大多数对于铜死亡的研究主要是依托生物信息学展开,通过TCGA等数据库的信息和生物信息学分析,可以筛选出与铜死亡相关的基因及可能存在的调控通路,并预测其与疾病间的关系。最\新的研究进展包括(但不限于):
P53基因可能与铜死亡的调控紧密相关。P53基因是重要的癌症抑制基因,同时,它调控了多个与糖酵解和氧化磷酸化途径相关的位点,这可能使其具有在不同应激条件下促进或抑制铜死亡的能力【1】。
对比肾透明细胞癌(ccRCC)患者的肿瘤组织和正常组织,发现CDKN2A基因表达显著上升,而FDX1和LIAS的表达则呈下降趋势。这些基因都在铜死亡的调控中发挥了重要作用【2】。
铜死亡与急性髓性白血病(AML)相关,可以通过与铜死亡相关的长链非编码RNA(lncRNA)特征来预测AML患者的预后并告知潜在的治疗策略【3】。
铜死亡相关基因SLC31A1、DLAT、ATP7A和ATP7B在乳腺癌样本中的表达显著高于正常组,其中SLC31A1的表达差异显著性最强【4】。
构建神经胶质瘤和铜死亡激活相关模型,可用于预测神经胶质瘤患者的预后、临床特征和亚型,并对靶向药物的筛选具有重要意义【5】。
糖尿病患者心脏中的蛋白质和mRNA谱变化与铜死亡一致,包括ATF3、SPI1和SLC31A1的表达均出现升高【6】。
铜死亡相关基因LIPT1在黑色素瘤的发生和发展中出现明显的差异性表达【7】。
铜死亡相关基因在肝癌细胞中有显著的差异化表达【8】。
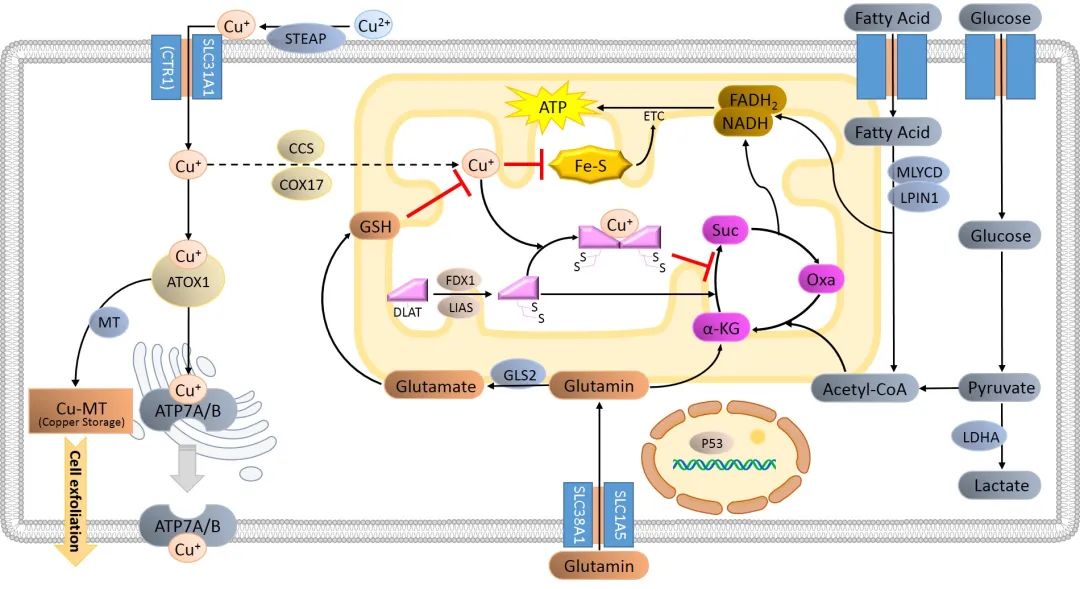
铜代谢和铜死亡相关的调控通路
03 铜死亡与疾病
新的细胞死亡机制往往会带来新的疾病治疗思路。对于铜死亡和铜稳态的调控也有望应用于多种类型的疾病应对方案。
调控铜稳态应对遗传性疾病。Menkes病(MD)和Wilson病(WD)分别由ATP7A和ATP7B基因突变导致的细胞铜输出功能异常引发。MD的发病原因是铜离子在肠细胞内积累,无法运输至身体其他部位,目前常用铜盐进行治疗;而WD是因为铜离子在大脑和肝脏内过度积累,引发相关疾病,目前使用铜螯合剂可有效干预。
铜离子调控应对神经退行性疾病。包括阿尔兹海默症(AD)、肌萎缩侧索硬化症(ALS)、亨廷顿病(HD)等在内的多种神经元疾病都被证实可以通过使用铜螯合剂或对铜离子转运蛋白表达调控来进行干预。
铜死亡与心血管疾病。目前,已有流行病学证据表明血清中铜的含量升高会增加动脉粥样硬化疾病风险,但具体的机理和代谢通路仍有待研究。
铜死亡与癌症。铜是细胞信号传导的关键因素,通过促进细胞增殖、血管生成和转移参与癌症的发生和发展。与铜相关的癌症治疗策略主要有两个方面,一是利用相应的铜螯合剂来降低铜的生物利用度,从而抑制肿瘤细胞的生长、复发和转移等;二是提供过量的铜来诱导癌细胞发生铜死亡,在这一过程中,纳米材料与铜形成的配合物体系可能是一种十分具有前景的研究方向,它既保留了铜离子诱导铜死亡的治疗效果,又解决了铜配合物可能具有全身高毒性和高疏水性的问题。包括乳腺癌、结直肠癌、胰腺癌、肺癌等在内的癌症都有望使用诱导铜死亡的方式来进行应对治疗。
04 结语
铜死亡的概念已被推出一年多。后期,对于铜死亡的研究将逐渐从生信分析转向实验研究,全面探索铜死亡在相关疾病发展过程中的潜在机制,同时深入研究不同病理背景下铜死亡的相关调控通路。相较已保持研究热度上十年的铁死亡,铜死亡的研究仍处于起步阶段,这些热门研究的势头在今后较长的一段时间内可能都不会衰减。
参考文献
[1]. Chen Xiong, Hong Ling, Qian Hao, et al. Cuproptosis: p53-regulated metabolic cell death? Cell Death & Differentiation, 2023(30): 876-884.
[2]. Zilong Bian, Rong Fan, Liming Xie. A Novel Cuproptosis-Related Prognostic Gene Signature and Validation of Differential Expres sion in Clear Cell Renal Cell Carcinoma. Genes, 2022, 13(5): 851.
[3]. Pian Li, Junjun Li, Feng Wen, et al. A novel cuproptosis-related LncRNA signature: Prognostic and therapeutic value for acute myeloid leukemia. Front Oncol, 2022 Oct 7;12:966920.
[4]. Lirong Li, Lin Li, Qiang Sun. High expression of cuproptosis-related SLC31A1 gene in relation to unfavorable outcome and deregulated immune cell infiltration in breast cancer: an analysis based on public databases. BMC Bioinformatics, 2022.
[5]. Bo Chen, Xiaoxi Zhou, Liting Yang, et al. A cuproptosis activation scoring model predicts neoplasm-immunity interactions and personalized treatments in glioma. Comput Biol Med, 2022, 8, 148:105924.
[6]. Shenqi Huo, Qian Wang, Wei Shi, et al. ATF3/SPI1/SLC31A1 Signaling Promotes Cuproptosis Induced by Advanced Glycosylation End Products in Diabetic Myocardial Injury. International Journal of Molecular Sciences, 2023, 24, 1667.
[7]. Haozhen Lv, Xiao Liu, Xuanhao Zeng, et al. Comprehensive Analysis of Cuproptosis related genes in Immune Infiltration and Prognosis in Melanoma. Front Pharmacol, 2022, 28, 13:930041.
[8]. Duguang Li, Zhaoqi Shi, Xiaolong Liu et al. Identification and development of a novel risk model based on cuproptosis-associated RNA methylation regulators for predicting prognosis and characterizing immune status in hepatocellular carcinoma. Hepatology International, 2023(17): 112-130.