#01 什么是同型对照?
同型对照(Isotype Control),是指与使用的流式抗体具有相同种属来源、亚型、荧光标记物、使用剂量和浓度,但对目标靶点无特异性结合的抗体。同型对照通常用来消除抗体与抗原的非特异性结合造成的背景染色。
#02 为什么要做同型对照?
流式抗体与靶标的结合,是通过抗体的Fab端与靶标Marker进行特异性结合而完成的。白细胞(除T细胞外)表面大多表达CD16、CD32、CD64等Fc受体,这些受体可与各种抗体的Fc端非特异性结合,出现非特异性染色。其中,以单核细胞、巨噬细胞尤甚。
此外,除Fc受体的影响外,在活细胞的表面染色实验中,单核细胞和巨噬细胞均存在吞噬抗体或与荧光染料发生非特异性结合的现象。并且,在多色流式实验中,还存在荧光背景的影响及药物处理的影响,即便对Fc受体进行了封闭,在分群不好的情况下,依然需要用到同型对照。此时,同型对照的使用也就十分重要。
实验时,如果仅仅参照空白对照来圈门,就可能出现一部分假阳性结果。如果参考同型对照来区分阴阳性,就能够把这部分非特异性结合造成的假阳性排除。

![]() FcR分子
FcR分子
![]() 目标蛋白分子
目标蛋白分子
以CD45+白细胞样本为例,在排除了死细胞和粘连体后,未进行染色、也未进行Fc受体阻断的空白样本,各通道荧光处于低水平。如图所示:
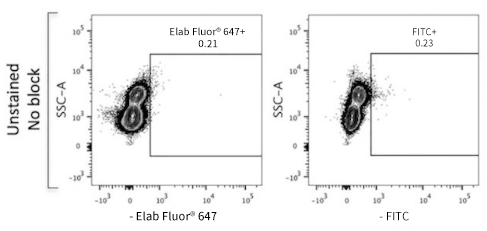
染同型对照后,背景荧光增强。

针对这种因FcR导致的强背景,建议可以添加FcR封闭剂,如下图所示:阻断FcR后,染同型对照,背景荧光恢复到与空白相似。

#03 什么时候需要做同型对照?
(1)对于阴阳性分群明显的指标,不需要同型对照即可设门,例如CD3、CD4、CD8等用于T细胞的检测指标。对于阴阳性分群不清楚的指标,例如CD25、CD69、CD38等活化指标,及IFN-γ、IL-4、IL17A等细胞因子,则需要设置同型对照,实现阴阳性细胞群的良好区分。
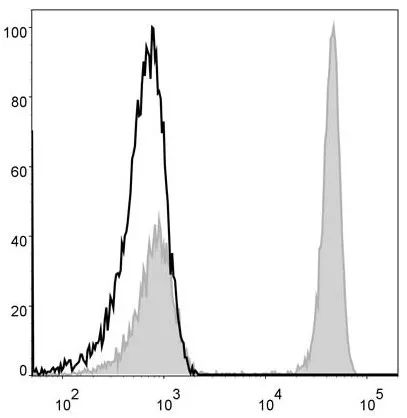

CD4 CD25
(2)在某些特殊情况下,如单核细胞被PE/Cyanine 7、APC/Cyanine 7等串联染料标记的抗体染色时,使用同型对照抗体是十分有必要的。单核细胞一般倾向于与Cyanine7等染料非特异性结合,使用同型对照抗体有助于获得理想结果。
(3)不清楚抗原表达情况的时候,一定要使用同型对照来界定阴性细胞群。
(4)胞内染色时,因为胞内指标表达量一般不会太高,胞内染色过程也非常容易导致抗原抗体非特异性结合。
#04 同型对照选择原则
相同种属来源 – Mouse、 Rat、Hamster
相同亚型 – IgG1、IgG2a、 IgG2b、 IgG3、 IgM
相同荧光标记 – FITC、PE、 PerCP/Cyanine5.5、 PE- Cyanine7 、APC等
相同用量及浓度(非体积)
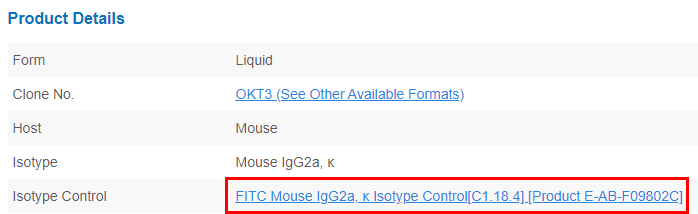
除了参考同型对照选择原则,还可以前往Elabscience®官网,点击每个流式抗体对应的同型对照链接,查看配套同型对照数据。示例:

下拉产品详情,可找到对应同型对照:
流式实验中,同型对照具有不可替代的意义,同时也有一定的局限性。因此,我们需要根据具体实验情况,来判断同型对照是否需要联合其它方法一起使用。例如:
① 对于阴阳性分群明显的指标,不需要同型对照,即可正确圈出阳性细胞群;
② 同型对照只能作为一种参考,但不能直接、单纯地以此为依据,来确定阳性阴性分界点,或以此圈门。因为同型对照只能反映非特异性结合的背景荧光,不能排除其他相关影响因素;
③ 由于死细胞的非特异性染色较强,如果样本中存在死细胞,需要使用同型对照与死活染料,来减少假阳性;
④ 如果使用同型对照时,发现非特异性结合水平很高,建议使用阻断剂来阻断FcR;
⑤ 如果实验中同时用到了多种荧光素,在进行分析时,荧光渗漏对结果的影响较为明显,同型对照无法反映出其它通道渗漏的荧光背景。这时可能需要通过同型对照与FMO对照的联合使用,消除荧光溢漏和非特异性结合造成的影响。
相关阅读: