阿尔兹海默症(Alzheimer’s Disease,AD)俗称老年痴呆症,是由于神经细胞损失而导致的一种起病隐匿、不可逆的进行性神经系统退行性脑疾病,以记忆障碍、失语、失认等为主要症状。目前,全球AD患者约有5000万人,中国患者占到其中的四分之一。阿尔兹海默症防治相关研究,一直是神经科学领域的重难点。
01阿尔兹海默症的发病机制
迄今为止,AD的确切病因和发病机制尚不明确。从发病人群来看,AD多见于65岁以上的老人,且女性患者多于男性,比例大约为3:1。随着年龄增长,其发病率有逐渐增高的趋势,84岁以上人群可达47%。
AD的病理现象较为复杂。据大脑组织检查结果显示,AD患者普遍存在脑神经细胞外大量β-淀粉样蛋白(β-amyloid,Aβ)沉积形成的老年斑、tau蛋白异常磷酸化形成的细胞内神经原纤维缠结(neurofibrillary tangles,NFTs)、神经元丢失、神经营养不良、突触丢失等病理现象,但发病机制并不明确。
目前,关于AD的发病机制有以下几个学说:
中枢胆碱能系统损伤学说
β-淀粉样蛋白(Aβ)学说
tau蛋白异常磷酸化学说
炎症损伤学说
兴奋性神经损伤学说
肠道菌群学说
其中,Aβ学说和tau蛋白异常磷酸化学说,是AD成因的主流学说,认为其基本病变是Aβ和tau在脑组织特定部位积蓄形成斑块和缠结所致。Aβ的产生是导致AD的关键。

图:大脑中的淀粉样蛋白斑块是AD患者的标志性特征之一
02阿尔兹海默症如何诊断?
AD存在病程长、潜伏期长(临床前期:15~20年,痴呆前期、痴呆期:10~15年)的特点,神经细胞损伤的不可逆性导致其难以治愈。要想延缓或阻止AD的进程,关键在于早期干预。
但遗憾的是,我国大多数AD患者在就诊时就已属中晚期。因此,AD的早期诊断和及时干预,成为了目前唯一有效延缓病情的措施。
AD的早期诊断方法包括:神经心理量表(临床痴呆评定量表CDR、认知功能量表)、体液标志物的检测、影像标志物检测等。综合多种手段科学评估,尽可能地将诊断阶段提前,就能为及时干预争取更多时间。
我们查阅整理了多篇文献信息,罗列出了与AD研究和诊断最相关的一些手段和指标:
|
脑脊液标志物 |
功能 |
|
β淀粉样蛋白(Aβ) |
Aβ是AD的主要病理标志,反映了皮层淀粉样蛋白的沉积。沉积的Aβ会导致神经突退缩和神经元变性 |
|
tau蛋白 |
总tau蛋白(t-tau)反映神经变性的密度,磷酸化tau蛋白(p-tau)与神经原纤维缠结的病理改变相关,可以检测AD的连续性病理变化 |
|
β-分泌酶1(BACE1) |
BACE1是Aβ生成途径中的限速酶,AD患者中BACE1蛋白浓度和活性更高,可作为AD早期的治疗靶点 |
|
神经丝轻链蛋白(NfL) |
NfL是神经元轴突的细胞骨架蛋白之一,NfL水平随着AD疾病的进展而升高 |
|
几丁质酶-3样蛋白-1(YKL-40) |
YKL-40是一种大脑蛋白,可作为炎症标记物,参与清除大脑中潜在的AD蛋白的毒性堆积 |
|
神经元正五聚蛋白II(NPTX2) |
NPTX2是神经穿透素蛋白家族的成员之一,该蛋白与认知能力和海马体积相关。AD患者表现出NPTX2含量降低 |
|
微小RNA(miRNA) |
miR-29a/b-1簇的丧失与AD中增加的BACE1活性相关,指向潜在的致病关联 |
|
视锥蛋白样蛋白1(VILIP-1) |
VILIP-1是高度表达的神经元钙离子感受器蛋白。研究发现,重度AD患者的CSF中VILIP-1水平显著增高 |
|
F2-异前列烷 |
在AD的发病机制中,自由基损伤神经元后会导致脂质过氧化,从而增加F2-异前列烷的产生 |
|
血液标志物 |
功能 |
|
Aβ蛋白和tau蛋白 |
同上 |
|
肿瘤坏死因子(TNF-α) |
TNF-α可以促进T细胞产生各种炎症因子,进而导致炎症的发生 |
|
载脂蛋白E(APOE) |
检测AD患者和MCI(轻度认知障碍)患者时,血液中低水平的APOE与海马体积的缩小存在明显关系 |
|
血小板APP比值 |
Aβ蛋白起源于类淀粉前体蛋白(APP)。APP有不同的分子量亚型,通常AD患者的APP比值(120~130 KDa/110 KDa)比正常人低 |
|
可溶性低密度脂蛋白受体相关蛋白(SLRP) |
在AD患者的老年斑中,可以检测到低密度受体相关蛋白-1(LRP1)。SLRP是LRP1的胞外段,被剪切后,释放入血浆中的515KDa蛋白。它可以阻止外周血中的大部分Aβ蛋白通过血脑屏障进入脑内 |
03阿尔兹海默症的其他诊断指
除以上指标外,近年来,国内外各个科研团队也在AD的发病机制、新生物标志物的筛选及治疗药研发中,付出了诸多努力。
PDGFRβ
荷兰拉德堡德大学医学中心Anna de Kort团队[1]在Alzheimer's & Dementia杂志上发表了一篇题为Normal cerebrospinal fluid concentrations of PDGFRβ in patients with cerebral amyloid angiopathy and Alzheimer's disease的文章,他们通过酶联免疫吸附法,对CAA患者、aMCI/AD患者及相匹配对照组的CSF PDGFRβ(脑脊液血小板源性生长因子受体-β)水平进行了定量分析,以探讨PDGFRβ水平作为大脑淀粉样血管病(CAA)、遗忘性轻度认知障碍(aMCI)与阿尔兹海默症(AD)的生物标志物的可能性。结果发现,PDGFRβ水平与AD+生物标志物特征有关,但不适合作为CAA或aMCI/AD临床综合征的生物标志物。
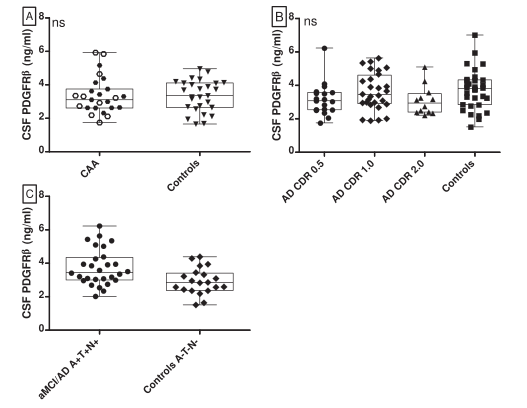
图: 与对照组相比,CAA和aMCI/AD患者CSF PDGFRβ的水平。
A. CAA患者与对照组CSF PDGFRβ水平的比较。白色六边形代表来自RUMC(拉德堡德大学医学中心)的CAA患者,黑色六边形代表来自MGH
(麻省总医院)的CAA患者。两者水平相似(P=0.88)。
B. 对照组、aMCI患者(AD CDR 0.5)、轻度痴呆(AD CDR 1.0)和中度痴呆(AD CDR 2.0)的CSF PDGFRβ水平。各组水平相似(P=0.29)。
C. 具有正常AD生物标志物(A–T–[N–])的对照组和具有阳性AD生物标志物(A+T+[N+])的aMCI/AD患者的PDGFRβ水平。PDGFRβ水平在各组
间存在显著差异,P=0.006。
GFAP
Joana B Pereira团队[2]在BRAIN上发表了题为Plasma GFAP is an early marker of amyloid-β but not tau pathology in Alzheimer’s disease的文章,他们检测了217名Aβ(β-淀粉样蛋白)阴性认知未受损、71名Aβ阳性认知未受损、78名Aβ阳性认知受损,以及63名Aβ阴性认知受损患者的血浆中星形胶质细胞标志物GFAP的水平。结果显示,血浆GFAP是淀粉样蛋白-β的早期标志物,但不是AD中tau病理学的早期标志物。这表明,GFAP应纳入当前假设的阿尔兹海默症发病机制的模型中。
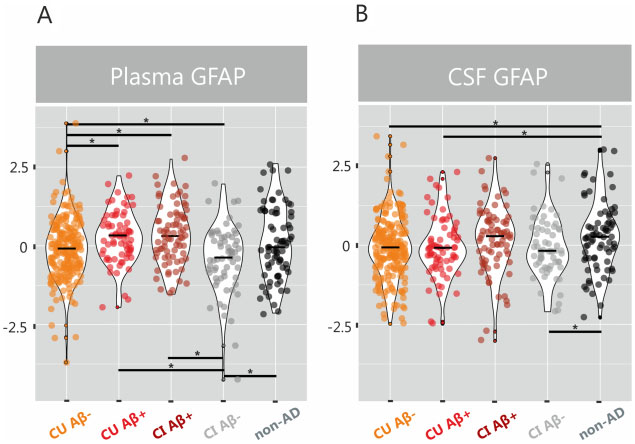
图:β-淀粉样蛋白阳性组血浆和脑脊液(CSF)中GFAP浓度升高。
小提琴图A、B分别显示:在调整患者年龄和性别之后,β-淀粉样蛋白阴性认知未受损个体(CU Aβ–)、β-淀粉样蛋白阳性认知未受损个体(CU
Aβ+)、β-淀粉样蛋白阳性认知受损个体(CI Aβ+)、β-淀粉样蛋白阴性认知受损个体(CI Aβ–)的血浆、脑脊液中GFAP(z-分数)中值。
*表示使用FDR校正进行多重比较调整后的组间显著性差异(q<0.05)。
外泌体相关蛋白
Longfei Jia团队[3]通过两阶段的截面研究,探讨了外泌体突触蛋白能否作为AD无症状期的预测因子。结果显示,AD中生长相关蛋白43(GAP43)、神经颗粒蛋白、突触体相关蛋白25(SNAP25)和突触结合蛋白1的浓度低于对照组(P<0.001)。外泌体生物标志物水平与脑脊液中的水平相关。该研究表明,外泌体GAP43、神经颗粒蛋白、SNAP25和突触结合蛋白1,可作为预测认知障碍前5至7年AD的有效生物标志物。
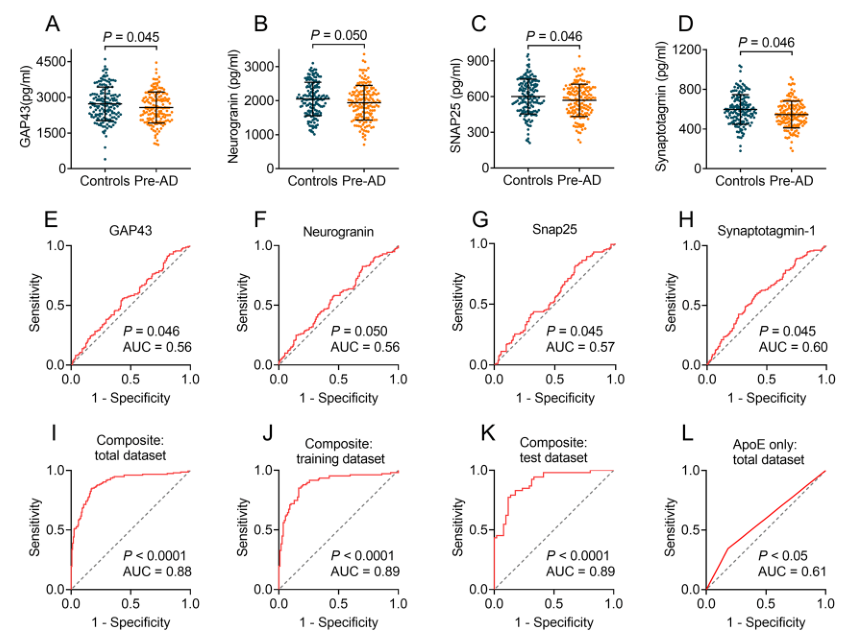
图:外泌体生长相关蛋白43(GAP43)、神经颗粒蛋白、突触体相关蛋白25(SNAP25)和突触结合蛋白1对临床前阿尔兹海默症(AD)的预测。
图A-D显示了临床前AD和对照中神经元衍生的外泌体GAP43(A)、神经颗粒蛋白(B)、SNAP25(C)和突触结合蛋白1(D)的水平。
图E-H显示了GAP43(E)、神经颗粒蛋白(F)、SNAP25(G)和突触结合蛋白1(H)的接收器操作特征(ROC)分析。
图I-K显示了通过组合总数据集(I)、随机选择的训练数据集(J)和测试数据集(K)中的外泌体GAP43、神经颗粒蛋白、SNAP25、突触结合蛋白1
和APOEε4(载脂蛋白E)状态的ROC分析。
由于AD的发病机制复杂,缺乏精准的诊断手段及针对明确病理机制的药物,目前,在该领域的研究上,仍存在巨大的探索和突破空间。不过,随着越来越多的科研人员投身其中,更多AD标志物被发现和研究,相信在不远的将来,人类终将攻克这一重大疾病难题!
●参考文献●
[1] AMD Kort, Kuiperij H B, Kersten I, et al. Normal cerebrospinal fluid concentrations of PDGFRβ in patients with cerebral amyloid angiopathy and Alzheimer's disease[J]. Alzheimer's & Dementia, 2021.
[2] Joana B Pereira, Shorena Janelidze, Ruben Smith, et al. Plasma GFAP is an early marker of amyloid-β but not tau pathology in Alzheimer’s disease[J].Brain, 2021,144(11):3505–3516.
[3] Longfei Jia, Min Zhu, Chaojun Kong, et al. Blood neuro‐exosomal synaptic proteins predict Alzheimer's disease at the asymptomatic stage[J]. Alzheimer's & Dementia, 2021,17(1):49-60.
