上期内容,我们分享了专题内容《靶标解读 | NPC1:三阴性乳腺癌(TNBC)治疗的新希望》,重点介绍了三阴性乳腺癌的分子类型、病理学特征及其潜在治疗靶点NPC1,希望大家能有所收获。本期我们来盘点一下肝癌的生物标志物,以期为肝癌的诊断提供新的视角和思路。
肝癌,作为世界范围内较为常见且恶性程度高的肿瘤之一,其发病率和致死率在我国尤为突出,其中,原发性肝癌最为高发。原发性肝癌主要分为肝细胞癌(HCC)、肝内胆管癌(ICC)以及HCC-ICC混合型三种类型,其中肝细胞癌(HCC)是最主要的病理类型,约占90%,因此本文中提及的肝癌在很大程度上特指HCC。肝癌的发病通常隐匿,多数患者在确诊时已处于中晚期,错过了手术治疗的最佳时机,且常伴有肝硬化和肝功能异常,预后较差。近几十年来,肝癌的生存率未见显著改善,因此,肝癌的预防与早期诊断成为全球关注的重点。

(一)肝癌的发病机制
肝癌的发生发展是一个较为复杂的过程,通常包括多种因素多个步骤,涉及持续的炎症损伤。其病因主要包括几个方面:乙型肝炎病毒感染(Hepatitis B,HBV),丙型肝炎病毒(Hepatitis C,HCV)、饮酒、代谢性疾病、年龄和吸烟等因素。[1]
任何病因引起的肝硬化都是肝细胞癌的最强危险因素,肝细胞癌是肝硬化患者死亡最主要的原因。每年,肝细胞癌的发病率约为1~6%。肝癌的发生通常经过
慢性肝炎-肝硬化-肝癌三个阶段,即经典的肝癌“三部曲”。因此,任何可能导致慢性肝损伤并最终导致肝硬化的病因均应被视为肝细胞癌的危险因素。

图1A-图1B. 肝细胞肝癌MSCT图像;
图1A. 病灶呈均匀强化,可见等密度的假包膜;图1B:动脉期肝细胞肝癌周边出现明显强化效应。
图2A-图2B. 肝硬化结节MSCT图像;
图2A. 肝包膜边沿不光整,肝裂增宽;图2B:肝脏表面平滑,呈现多发小结节。
(二)肝癌如何诊断?
肝癌的早期临床症状并不明显,通常在晚期阶段被诊断出来,许多患者因此错过了最佳的治疗时间。肝癌的转移难以被有效识别,加之其较高的复发风险,导致了肝癌的预后并不乐观。因此,了解和发现肝癌早期诊断和判断预后的相关生物标志物,对于临床肝癌患者治疗有很大的意义。[2]

图2. 不同类型的肝癌HE染色结果
图2A. 脂肪性肝炎肝细胞癌。肿瘤细胞表现出脂肪性肝炎的特征,包括脂肪变性、气球样变性和Mallory-Denk小体(200×);
图2B. 纤维板层肝细胞癌。由平行胶原纤维组成的多个纤维隔膜将肿瘤小梁隔开(100×);
图2C. 硬肝细胞癌。致密纤维化带将肿瘤细胞的索状物和巢状物分开(200×);
图2D. 混合性肝细胞癌-胆管癌。常规肝细胞癌区域(中下至右)与离散腺体形成区域(左上)混合(40×)。
我们查阅整理了多篇文献信息,罗列出了与肝癌研究和诊断最相关的一些手段和指标:
肝癌标志物 | 功能 |
甲胎蛋白(AFP) | AFP是发育中的胎儿的卵黄囊和肝组织产生的一种血清蛋白,如果血清中AFP持续8周大于200 μg/L,或者4 周高于400μg/L,可能出现原发性肝癌 |
甲胎蛋白晶状体凝集素3(AFP-L3) | AFP-L3是AFP的一种亚型,在肝硬化或肝炎背景下的 HCC 筛查和诊断中具有很高的特异性 |
脱-γ-羧基凝血酶原 (DCP) | DCP是凝血酶原的非功能前体,在鉴别AFP阴性的HCC和排除AFP阳性的非HCC疾病方面有较好的作用,对乙肝人群的HCC早期诊断、疗效和预后监测方面也优于AFP |
高尔基体蛋白-73(GP73) | GP73是一种在肝细胞癌等肝病中表达水平上升的II型上皮细胞的高尔基体跨膜蛋白,,可以在血清中被检测到 |
Mac-2结合蛋白糖基化异构体(M2BPGi) | 是一种存在于多种器官组织中(包括肝组织)的细胞外基质和血清中的新型、快速的糖生物标志物,对各种肝性疾病的诊断具有重要的作用,HCC的患者M2BPGi表达量显著高于未发生HCC的患者中的M2BPGi,对HCC的发生发展有良好的预测能力 |
肝素结合细胞因子(MDK) | 是一种富含半胱氨酸的肝素结合生长因子,也叫做神经突生长促进因子2,在肝细胞癌的组织和血清中的表达水平均显著的提高 |
磷脂酰肌醇蛋白聚糖3(GPC-3) | GPC-3是一种膜相关蛋白聚糖,可以在肿瘤细胞中特异表达。GPC-3在不同的肿瘤中有不同的表达量,在肺癌和黑色素瘤中低表达,而在肝癌中表达上调 |
骨桥蛋白(OPN) | OPN是一种磷酸化糖蛋白,参与机体多种生理及病理过程, 肿瘤患者血清OPN水平升高常伴随预后不良,在肝癌转移组织中OPN表达显著升高,并且与低生存率和高复发率相关,在HCC中的诊断和预后中具有重要临床意义 |
半乳糖凝集素3结合蛋白(LGALS3BP) | LGALS3BP是一种分泌型、高糖基化蛋白,与肝癌的预后密切相关,在HCC患者中,总生存期高的患者血清LGALS3BP 表达较正常范围低,其高表达可能与HCC患者的不良预后相关 |
(三)肝癌的其他诊断指标
除以上指标外,近年来,国内外各个科研团队也在肝癌的发病机制、新生物标志物的筛选及治疗药研发中,付出了诸多努力。
PIVKA-II
天津市肿瘤临床研究中心冯红蕾团队[3]通过酶联免疫吸附法,对肝癌患者(HCC)、良性患者(BLD)及健康对照组(HC)的PIVKA-II(凝血酶原-II)水平进行了定量分析,以探讨PIVKA-II水平作为诊断HCC的血清生物标志物的可能性。结果发现,HCC患者的PIVKA-II血清浓度明显高于BLA和HC患者,可作为HCC的潜在生物标志物。

图3. 健康对照者(HC)、良性肝病患者(BLD)及肝癌患者(HCC)血清PIVKA-II的水平。所有P<0.0001。
SF3B4
Ju A Son团队[4]检测了健康对照组(HC)、肝硬化患者(LC)、早期HCC患者(诊断前1年、诊断前6个月和诊断时)的血浆中SF3B4(剪接因子3b亚基4)的水平。结果显示,SF3B4自身抗体从LC组到HCC组均呈阳性表达,但在对照组中未检测到,表明SF3B4 自身抗体作为生物标志物表现出显著的特异性和敏感性,AUC为0.8。进一步的验证结果发现,虽然HCC患者血浆中的SF3B4 蛋白表达高于 HC,但CH患者(慢性肝炎)与LC或HCC患者之间没有显著差异。同样,HCC患者血浆样本中的抗 SF3B4 自身抗体表达高于 HC。表明血浆SF3B4蛋白水平和抗SF3B4自身抗体的诊断性能低于或类似于血清AFP。
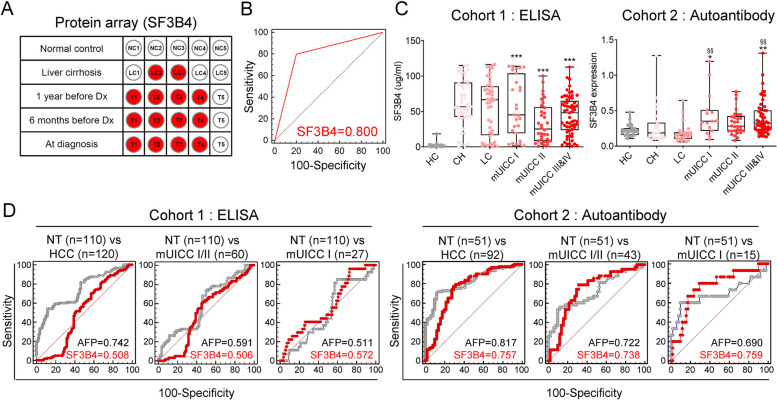
图4. SF3B4血浆蛋白和抗SF3B4自身抗体作为HCC液体活检生物标志物的表达及其在各队列中的诊断性能
A. 正常组织和肝硬化至HCC(Dx,HCC诊断)中SF3B4自身抗体表达的阳性点。
B. SF3B4自身抗体的ROC分析。
C. 根据肝病分期,血浆SF3B4的表达和血浆抗SF3B4自身抗体的表达。使用单因素方差分析和Tukey多重比较检验确定统计学上的显着差异。与HC相比;***P <0.001,与LC相比;**P < 0.01。
D. 队列1中的血浆SF3B4(左)和队列2中的抗SF3B4自身抗体(右)与血清AFP相比在诊断HCC方面的AUC。从左到右:诊断所有阶段的HCC、mUICC I期或II期以及mUICC I期。
GLS1
南京大学张来珠团队[5]通过受试者工作特征曲线和Cox回归模型,评估了GLS1(肾型谷氨酰胺酶)对HCC的诊断和预后效能,探讨了GLS1能否作为HCC的预测因子。结果显示,GLS1诊断HCC的灵敏度、特异度、阳性预测值、阴性预测值、约登指数和曲线下面积分别为0.746、0.842、0.979、0.249、0.588和0.814,与磷脂酰肌醇聚糖3 (GPC3)和甲胎蛋白(AFP)联合使用时可提高,表明诊断性能更好。此外HCC中GLS1的表达还与年龄、T 分期、TNM分期、Edmondson-Steiner分级、微血管侵犯、Ki67、VEGFR2、GPC3和AFP表达有关。 GLS1 表达与 HCC 患者的无病生存概率呈负相关(P < 0.001)。该研究表明,GLS1是HCC病理诊断的敏感度、特异性生物标志物,并具有预后和临床实用价值。

图5. HCC 患者中 GLS1 表达与 Edmondson-Steiner 分级或 MVI 的关系(a、d、g和j)。HCC中GLS1的免疫组织化学染色定义为阴性(-)、弱阳性(+)、中度阳性(++)和强阳性(+++)(b、e、h和k)。Edmondson-Steiner I、II、III 和III级的苏木精和伊红染色结果(c、f、i和l)。(b、e、h和k)中黑色方块表示区域的放大倍数。(i和l)中的 MVI用黑色箭头表示。白色条=250 μm;黑色条=100 μm。
由于肝癌的发病机制复杂,缺乏精准的诊断手段及针对其明确病理机制的药物,目前在该领域的研究上仍存在巨大的探索和突破空间。不过,随着越来越多的科研人员投身其中,更多肝癌标志物被发现和研究,相信在不远的将来,人类终将攻克这一重大疾病难题!
参考文献:
1. Zhang Y, Liu J,Deng M. Application Value of MSCT Combined withSerum CCNA2 and AFP in the Differential Diagnosis of Cirrhosis Noduleand Hepatocelluar Carcinoma. Chinese J CT MRI, MAY. 2024:22(5):175.
2. El Jabbour T, Lagana SM, Lee H. Update on hepatocellular carcinoma: Pathologists' review. World J Gastroenterol. 2019;25(14):1653-1665.
3. Feng H, Li B, Li Z, Wei Q, Ren L. PIVKA-II serves as a potential biomarker that complements AFP for the diagnosis of hepatocellular carcinoma. BMC Cancer. 2021;21(1):401.
4. Son JA, Weon JH, Baek GO, et al. Circulating small extracellular vesicle-derived splicing factor 3b subunit 4 as a non-invasive diagnostic biomarker of early hepatocellular carcinoma. J Exp Clin Cancer Res. 2023;42(1):288.
5. Zhang L, Su K, Liu Q, et al. Kidney-type glutaminase is a biomarker for the diagnosis and prognosis of hepatocellular carcinoma: a prospective study. BMC Cancer. 2023;23(1):1081.