上期推文给大家分享了专题内容《靶标解读丨血管生成关键因子—VEGF》(点击查看推文),重点介绍了VEGF的家族成员、血管生成机制和生物学功能,同时也向大家推荐了相关的ELISA产品,希望大家能有所收获。
本期为大家介绍炎症反应重要靶点——HMGB1。HMGB家族具有3个成员,包括HMGB1、HMGB2和HMGB3[1],其中HMGB1被称为高迁移率族蛋白1,是一种高度保守的核DNA结合蛋白。HMGB1在受到外源性细菌内毒素刺激时,以延迟的方式从活化的巨噬细胞、单核细胞或垂体细胞释放[2]。
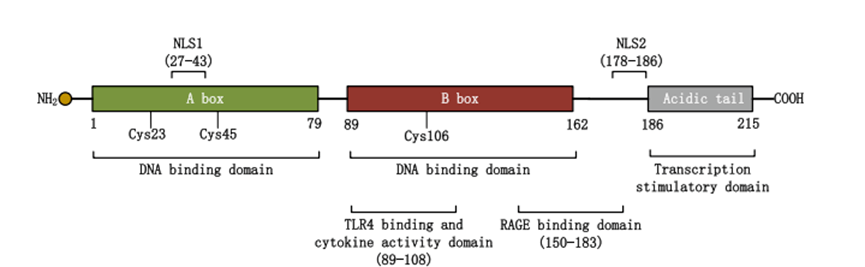
图1. HMGB1的结构和功能
HMGB1的功能活性
核HMGB1被认为是一种结构染色质结合因子[3],参与核小体结构的维持和基因转录,具有维持染色质稳定和参与细胞DNA重组等多种生物功能。而细胞外HMGB1也调控多种生物过程,如细胞分化[4],细胞迁移[5]和转移,细胞凋亡[6]和炎症反应等。研究表明,细胞外HMGB1可作为DAMP激活先天免疫系统,募集炎症细胞和平滑肌细胞,刺激巨噬细胞和内皮细胞产生促炎细胞因子,促进炎症反应。此外,细胞外HMGB1作为一种免疫分子,可触发免疫细胞和内皮细胞的炎症反应,随后,被HMGB1激活的免疫细胞和内皮细胞可以分泌HMGB1,形成一个正反馈回路。因此,HMGB1可以在多种刺激条件下维持长期的炎症状态。
HMGB1信号通路
1
HMGB1-RAGE信号通路
研究表明,HMGB1与细胞表面晚期糖基化终产物(RAGE)的受体具有高亲和力[7], RAGE在内皮、血管平滑肌、单核细胞和中枢神经系统中大量表达,已经在几种HMGB1结合蛋白中发现了一致的肽基序,包括p53、groucho相关基因蛋白1和5、RAGE和syndecan-1,RAGE的配体参与可激活细胞内信号通路,如p21ras、丝裂原活化蛋白激酶(MAPK)、NF-kB和Cdc42/Rac,并通过氧化敏感途径刺激人类单核细胞炎症反应,抑制RAGE-HMGB1相互作用可抑制肿瘤细胞中MAPKs的激活[4]。
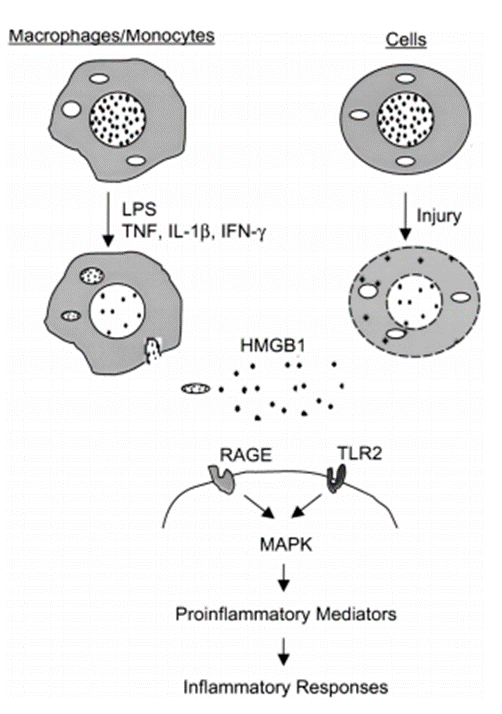
图2. HMGB1在炎症中的释放和信号转导
2
HMGB1-TLRs信号通路
TLR是一种主要由先天免疫细胞表达的跨膜受体,是先天免疫系统利用的模式识别受体(PRRs)家族的一员。在人类中,TLR1、TLR2、TLR4、TLR5和TLR6在细胞表面表达,而TLR3、TLR7、TLR8和TLR9在内体膜上表达。HMGB1可以与TLR(TLR2、TLR4和TLR9)相互作用,激活TLR信号,在配体的刺激下,TLRs招募下游连接分子,包括含TIR结构域的适配器诱导IFN-β(TRIF)和MyD88,这些分子随后激活NF-κB和IRF信号通路,促进参与免疫反应的细胞因子和趋化因子的产生,并诱导炎症。
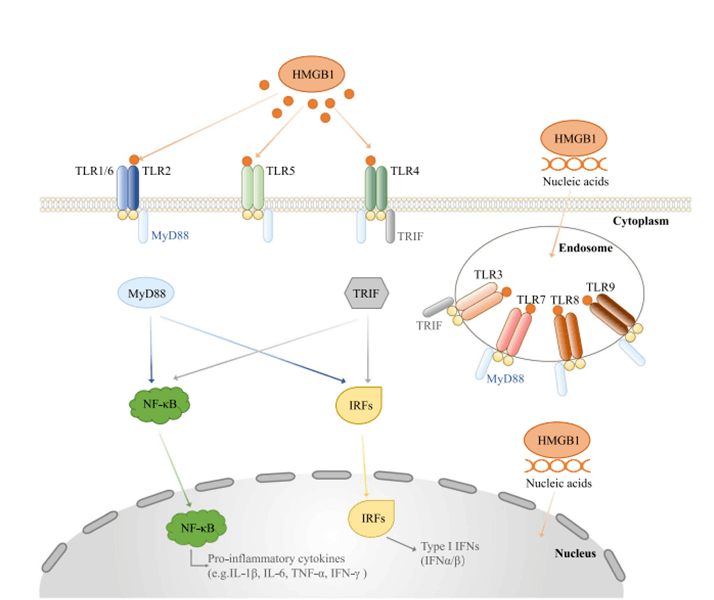
图3. HMGB1和TLRs信号通路
HMGB1在疾病中的作用
1
HMGB1与自身免疫病
HMGB1与toll样受体(TLR),如TLR2和TLR4结合,将HMGB1转化为促炎细胞因子,参与自身免疫性疾病的发生和发展。HMGB1和TLRs在一些自身免疫性疾病中上调,如类风湿关节炎、系统性红斑狼疮、I型糖尿病和自身免疫性甲状腺疾病。HMGB1和部分TLR在自身免疫性疾病患者和自身免疫性疾病动物模型的组织中表达上调,抑制HMGB1和TLRs可抑制炎症的进展。因此,HMGB1和TLR是自身免疫性疾病不可缺少的生物标志物和重要的治疗靶点[8]。
2
HMGB1与抑郁症
抑郁症是一种普遍存在的精神疾病,其发病机制难以捉摸。研究表明,中枢神经系统(CNS)无菌性炎症的增强和持续可能与抑郁症的发展密切相关。HMGB1可被中枢神经系统的神经胶质细胞和神经元释放为促炎细胞因子。小胶质细胞作为大脑的免疫细胞,与HMGB1相互作用,诱导中枢神经系统的神经炎症和神经退行性变[9]。
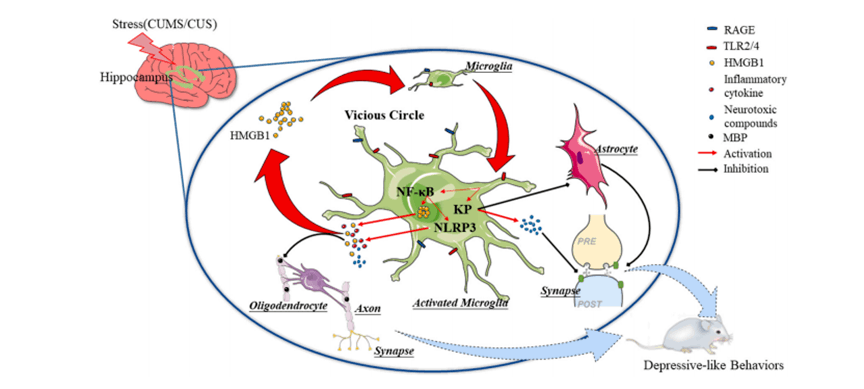
图4. HMGB1参与抑郁样行为的可能机制
3
HMGB1与缺血性中风
HMGB1广泛参与缺血性脑卒中的发生、缺血性脑损伤的病理损伤以及缺血性脑损伤后神经组织的修复。研究表明HMGB1在细胞死亡、免疫和炎症、血栓形成以及重塑和修复中发挥着重要作用。脑梗死后释放的HMGB1在脑梗死早期广泛参与病理损伤过程,而在脑梗死晚期则参与促进脑组织修复和重塑。HMGB1在急性脑白质卒中发挥神经营养作用,而在慢性脑白质缺血中引起炎症的持续激活和损伤作用[10]。
4
HMGB1与自噬在糖尿病发病
及其并发症中的关系
近年来的研究表明,自噬与糖尿病密切相关。在正常生理条件下,自噬促进细胞稳态,减少对健康组织的损伤,对糖尿病的调节具有双向作用。然而,在病理条件下,不受调节的自噬激活会导致细胞死亡,并可能导致糖尿病的进展。因此,恢复正常的自噬可能是治疗糖尿病的关键策略。HMGB1可在坏死、凋亡和炎症细胞中主动分泌或被动释放,可以通过激活多种途径诱导自噬。研究表明HMGB1在胰岛素抵抗和糖尿病中起重要作用,自噬与糖尿病诱导的器官损伤有关,HMGB1表达增加导致过度自噬,导致全身炎症反应和器官疾病,血清HMGB1水平升高可增加HMGB1与TLR4和RAGE的相互作用,从而增强凋亡和自噬信号通路的活性;抑制胰岛b细胞HMGB1可促进细胞凋亡,抑制自噬,导致细胞功能障碍。这些结果表明,HMGB1与自噬在糖尿病的进展过程中有很强的相关性[11]。
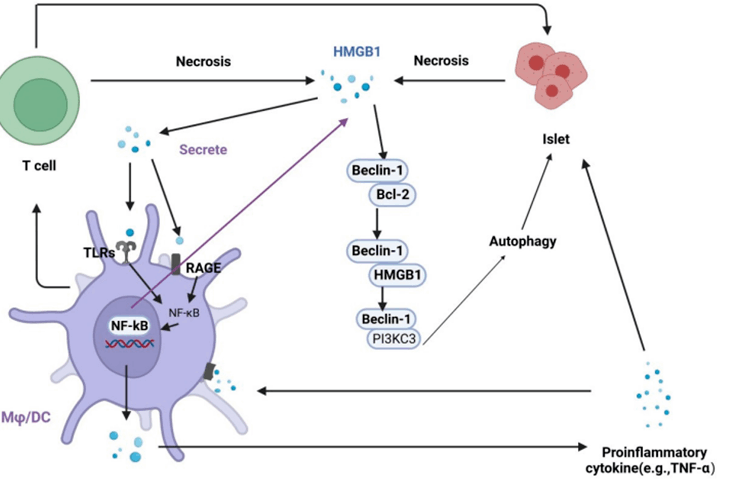
图5. 胰岛损伤中自噬与HMGB1相互作用的调控
HMGB1与多种疾病相关,如风湿病、关节炎、糖尿病、抑郁症等,其发挥作用的途径大多与RAGE信号通路和TLRs信号通路有关,抑制HMGB1的分泌与阻断相关的信号传导途径是抑制HMGB1所引起的炎症反应的有效措施。
以上,是分享给大家的关于炎症反应重要靶点——HMGB1的相关知识。
参考文献:
[1]
DavisDR Erlich JH.Cardiac tissue factor:roles in physiology and fibrosis.Clin Exp Pharmacol Physi 01.2008;35(3):342-8
[2]
Wang H , Bloom O , Zhang M H ,et al.HMG-1 as a Late Mediator of Endotoxin Lethality in Mice[J]. 1999. DOI:10.1126/science.285.5425.248.
[3]
Chen G, Ward M F , Sama A E ,et al.Extracellular HMGB1 as a proinflammatory cytokine.[J].Journal of interferon and cytokine research: The official journal of the International Society for Interferon and Cytokine Research, 2004(6):24.
[4]
Sparatore B , Passalacqua M , Patrone M ,et al.EXTRACELLULAR HIGH-MOBILITY GROUP 1 PROTEIN IS ESSENTIAL FOR MURINE ERYTHROLEUKAEMIA CELL DIFFERENTIATION[J].The Biochemical Journal, 1996:320.
[5]
Fages C , Nolo R , Huttunen H J ,et al.Regulation of cell migration by amphoterin[J].Journal of Cell ence, 2000, 113 ( Pt 4)(4):611-620.DOI:info:doi/10.1111/j.1523-536X.2008.00292.x.
[6]
Brezniceanu,M.-L.HMGB1 inhibits cell death in yeast and mammalian cells and is abundantly expressed in human breast carcinoma.[J].Faseb Journal, 2003.DOI:10.1096/fj.02-0621fje.
[7]
The Receptor for Advanced Glycation End Products (RAGE) Is a Cellular Binding Site for Amphoterin MEDIATION OF NEURITE OUTGROWTH AND CO-EXPRESSION OF RAGE AND AMPHOTERIN IN THE DEVELOPING NERVOUS SYSTEM[J].Journal of Biological Chemistry, 1995, 270.DOI:10.1074/jbc.270.43.25752.
[8]
Ren W , Zhao L , Sun Y ,et al.HMGB1 and Toll-like receptors: potential therapeutic targets in autoimmune diseases[J].Molecular Medicine, 2023, 29(1).DOI:10.1186/s10020-023-00717-3.
[9]
Xiao Huang , Bo Wang , Jing Yang ,et al. HMGB1 in depression: An overview of microglial HMBG1 in the pathogenesis of depression [J].Brain, Behavior, & Immunity - Health,2023,7(30),100641
[10]
Bin Gao,Shuwen Wang,Jiangfeng Li,et al. HMGB1, angel or devil, in ischemic stroke[J]. Brain and Behavior, 2023 ,DOI: 10.1002/brb3.2987
[11]
Kun Yang, Feng Cao, Weili Wang, et al. The relationship between HMGB1 and autophagy in the pathogenesis of diabetes and its complications[J]. Frontiers in Endocrinology,2023,3,29 DOI 10.3389/fendo.2023.1141516